Solubilidad
Se conoce como solubilidad a la capacidad que posee determinada sustancia para disolverse en otra y formar un sistema homogéneo. El resultado es una mezcla homogénea, en el que no se distinguen a primera vista las sustancias que la componen.
La mezcla está conformada por dos componentes: el soluto y el solvente. El soluto es la sustancia que se disuelve en la solución, mientras que el solvente es la sustancia donde se disuelve el soluto. Con esto en mente, la solubilidad designa cuánto soluto puede disolverse en un solvente concreto.

Por ejemplo, tenemos una taza de café caliente que actúa de solvente. Si ponemos un poco de azúcar, el soluto en este caso, se disolverá en el café con facilidad.
No obstante, si seguimos añadiendo azúcar, llegará un punto en el que quedarán partículas de azúcar sin disolverse. La razón es que cada sustancia tiene un nivel o grado de solubilidad diferente. Cuando se supera dicho nivel, el soluto que se añade después no se disolverá.
A raíz de la solubilidad, podemos hablar de la concentración, que es la proporción existente entre la cantidad de soluto y solvente en una solución.
Solubilidad según el tipo de solución
Existen distintos tipos de solución que, a su vez, indican el nivel o grado de solubilidad que admite la solución. Estos tipos son:
- Solución saturada, en la que no se puede disolver más soluto en la solución. En otras palabras, se ha alcanzado el grado de solubilidad que admite la solución.
- Solución sobresaturada, en la que hay más soluto de lo que admite el solvente para su disolución. Por lo tanto, se ha superado el nivel de solubilidad admitido en la solución.
- Solución insaturada, en la que la solución admite más soluto, y por ello, el nivel de solubilidad es alto. De aquí se disciernen soluciones diluidas, con poca cantidad de soluto, y soluciones concentradas, con mayor cantidad de soluto.
También podemos hablar de sustancias solubles e insolubles. Esta clasificación varía según factores como la temperatura, presión o el tipo de solvente presente en la solución. Es decir, ninguna sustancia posee un nivel de solubilidad fijo.
Ejemplos de solubilidad
- Las medicinas que se disuelven en agua, llamadas tabletas, comprimidos o polvos efervescentes. Al poner una de las tabletas en el agua, podemos ver que, poco a poco, la medicina se disuelve. Es vital seguir las indicaciones de cantidad de agua. Si se pone menos de la indicada, es posible que la medicina no se disuelva completamente.
- Las bebidas carbonatadas, conocidas como gaseosas, refrescos o sodas, contienen dióxido de carbono disuelto. Al abrir la lata o botella, la presión en el líquido baja, provocando que parte del dióxido de carbono disuelto escape en forma de burbujas. Esto sucede porque la solubilidad del gas en la bebida baja al reducir la presión.
- El mercurio, en su forma líquida, puede disolverse en algunos metales para formar las amalgamas dentales. No obstante, la solubilidad varía según la cantidad de mercurio utilizado, pudiendo servir como soluto o solvente de otros metales.
- El aceite, una sustancia apolar, no se disuelve en el agua, una sustancia polar. Por este motivo, el aceite no presenta ningún nivel de solubilidad en el agua.
Unidades y fórmulas para medir la solubilidad
La solubilidad de una solución química puede ser expresada en porcentaje de soluto respecto la cantidad total de solución. Las unidades más utilizadas son los moles de soluto por litro de solución (moles/l) o gramos de soluto por litro de solución (g/l).
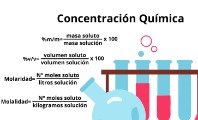
Cuando una solución se satura y no admite más soluto, la solubilidad se puede representar de las siguientes formas:
Otra forma de conocer la solubilidad de una sustancia es a través del coeficiente de solubilidad. Este coeficiente establece la cantidad necesaria de una sustancia para saturar una cantidad de solvente, a una temperatura y presión determinadas.
Por ejemplo, a 20 °C y 1 atm, el nitrato de plata (AgNO3) tiene una solubilidad alrededor de 216 g / 100 g de agua. En cambio, el nitrato de potasio (KNO3) solo presenta una solubilidad de unos 31 g / 100 g de agua. Por último, el oxígeno es tan poco soluble que solo se disuelven unos pocos miligramos por cada 100 gramos de agua.
Factores que afectan la solubilidad
Es importante destacar que no todas las sustancias se disuelven en los mismos solventes. La solubilidad viene determinada por varios factores: la temperatura, la presión, la polaridad, la cantidad de solvente y la presencia de otras sustancias.
Temperatura del soluto y solvente
La temperatura es uno de los factores que más afecta a la solubilidad. En general, un aumento de temperatura genera un mayor movimiento de las partículas de una sustancia líquida o sólida. Esto se traduce en una difusión más rápida y, por lo tanto, en mayor solubilidad.
Sin embargo, los gases suelen ser menos solubles en solventes líquidos conforme sube la temperatura. Es por ello que, para aumentar la solubilidad, habrá que incrementar o reducir la temperatura acorde a las sustancias presentes en la solución.
Presión del soluto y solvente
La presión es un factor importante en solutos gaseosos. La solubilidad de gases es directamente proporcional a la presión, de forma que aumenta mientras más presión se ejerza sobre la sustancia y la solución.
La presión también influye en la solubilidad de sustancias líquidas y sólidas, pero a un grado mucho menor comparado con otros factores.
Polaridad de las sustancias
El carácter polar o apolar de una sustancia es de suma importancia, ya que determina la capacidad de solubilidad de la misma. Una sustancia polar se suele disolver en un solvente polar, y una sustancia apolar en un solvente apolar.
Por un lado, el carácter polar representa la separación de las cargas eléctricas en la misma molécula. Por el otro, las moléculas apolares se producen por la unión entre átomos que poseen igual electronegatividad.
De esta manera, es fácil comprender por qué la gran mayoría de las sustancias inorgánicas, usualmente polares, se disuelven en el agua, un solvente polar. Por el contrario, las sustancias orgánicas apolares se disuelven en solventes orgánicos, como la parafina en la gasolina.
Cantidad de solvente en la solución
Una sustancia se disolverá más o menos según la cantidad de solvente que haya en la solución. Aunque un soluto tenga alta solubilidad en un solvente concreto, la solución se saturará rápidamente si hay poca cantidad de solvente.
Eso también significa que una solución tendrá un nivel alto de solubilidad si hay un volumen grande de solvente. Mientras más solvente contenga la solución, más soluto podrá disolverse en ella sin llegar a saturarse.
Presencia de otras sustancias
La solubilidad cambia cuando se mezclan varias sustancias. Cada sustancia reacciona con las demás de formas diferentes, así que su solubilidad puede aumentar o reducirse según las sustancias presentes en la solución.
Por ejemplo, el azúcar tiene diferentes niveles de solubilidad en agua, en café puro y en café con leche.
Producto de la solubilidad
El producto de la solubilidad es el producto de las concentraciones molares de iones en una disolución saturada, en la cual cada concentración se eleva a un exponente que coincide con el coeficiente estequiométrico en la ecuación de equilibrio de disolución.
Es de destacar, que el coeficiente estequiométrico hace referencia a las cantidades de reactivos y de productos que interviene en la reacción. Es lo que se conoce como los números que aparecen delante de las fórmulas de los reactivos y productos después de igualar la ecuación.
Por su parte, la constante del producto de solubilidad de un compuesto, representa el valor máximo que puede llegar a tener el producto de las concentraciones de los iones que se encuentran disueltos.
Vea también:
Cómo citar: Rhoton, Stephen (17/11/2023). "Solubilidad". En: Significados.com. Disponible en: https://www.significados.com/solubilidad/ Consultado: