Cobre (Cu)
El cobre, de símbolo químico Cu, es un metal blando de color pardo rojizo y brillante caracterizado por ser un buen conductor de calor y electricidad. Es uno de los metales más importantes en la industria metalúrgica, gracias a sus propiedades y la facilidad en trabajar con este elemento.
El cobre fue uno de los primeros metales en ser utilizado, teniendo un gran protagonismo desde la Prehistoria hasta la Edad del Cobre y del Bronce. Fue común su uso para la fabricación de herramientas y piezas para armas, o como uno de los componentes para crear estatuas.
Hoy en día, el cobre es el tercer metal más consumido en el mundo por detrás del hierro y el aluminio. En concreto, es ampliamente utilizado en la elaboración de cables, líneas de alta tensión, monedas, utensilios de cocina, instrumentos musicales y joyas, entre otros.

El cobre en a temperatura ambiente se encuentra en estado sólido.
El cobre, como otros metales, es un elemento que está presente en la composición del cuerpo humano. Sin embargo, en concentraciones altas se puede volver tóxico para los seres humanos y para el ambiente. Entre los alimentos que poseen un alto contenido de cobre están el hígado, las nueces, ostras, langostas y los vegetales, entre otros.
Ubicación del cobre en la tabla periódica
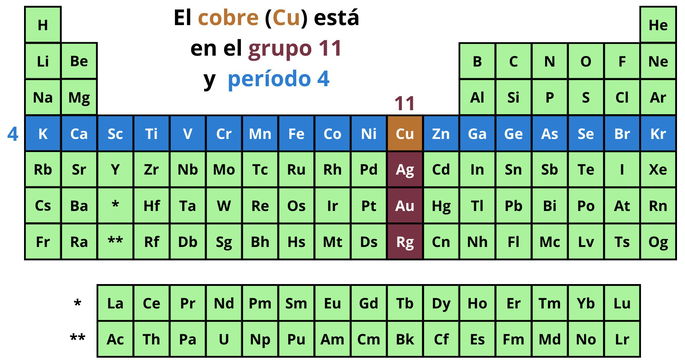
El cobre es un elemento metálico que da inicio a la familia del cobre, es decir, al grupo 11 de la tabla periódica. Dentro de este grupo, a este metal le siguen la plata (Ag), el oro (Au) y el roentgenio (Rg). A falta de conocer más datos del roentgenio, estos elementos conforman el grupo con las conductividades térmicas y eléctricas más altas.
Además, el cobre se ubica en el período 4, ya que forma parte de los elementos que presentan 4 capas de electrones. Dentro de este período, el cobre se sitúa entre el níquel (Ni) y el zinc (Zn).
Por la ubicación del cobre en la tabla periódica, también podemos clasificar este elemento como un metal de transición. Este tipo de metales son aquellos que se encuentran entre el grupo 3 y 12 de la tabla periódica.
Propiedades químicas y físicas del cobre
A continuación, se presentan las propiedades químicas principales del cobre:
- Símbolo químico: Cu.
- Número atómico: 29.
- Configuración electrónica: [Ar] 3d10 4s1.
- Masa atómica: 63,546 uma (unidad de masa atómica).
- Estados de oxidación: los más comunes son +1 y +2. Con menor frecuencia, +3 y +4.
- Isótopos más estables: 63Cu, el más abundante y con 34 neutrones; y 65Cu, con 36 neutrones.
- Conductividad eléctrica: 58,108 × 106 S/m.
- Conductividad térmica: 400 W/(K·m).
- Primera energía de ionización: 745,5 kJ/mol.
- Electronegatividad: 1,90 en la escala de Pauling.
Si comparamos estas propiedades con otros materiales, vemos que el cobre es el segundo elemento más conductor de electricidad y calor, solamente superado por la plata.
Otra característica a destacar es que, entre los metales, el cobre posee una electronegatividad alta. Esto implica que tiene mayor facilidad en ganar un electrón comparado con muchos otros metales.
Veamos ahora algunas propiedades físicas del cobre:
- Densidad: 8960 kg/m3.
- Punto de fusión: 1083 °C o 1357,77 Kelvin.
- Punto de ebullición: 2595 °C o 2835 Kelvin.
- Es un metal resistente, es decir, que no se rompe fácilmente.
- Posee una ductilidad y maleabilidad altas, por lo que se puede manipular, deformar y aplicar presión o tensión sin que se rompa.
- Es resistente a la corrosión, lo que le permite mantener sus propiedades y color durante un tiempo extendido.
- Posee un bajo coeficiente de expansión térmica, por lo que el cobre se dilatará o contraerá poco con los cambios de temperatura.
- Posee soldabilidad, pues las piezas de cobre se pueden reciclar o volver a unir mediante soldadura sin apenas perder sus propiedades.
Usos del cobre y sus derivados
Debido a las propiedades anteriormente mencionadas, el cobre es un metal muy versátil y posee una gran variedad de aplicaciones.
A continuación se presentan diferentes ejemplos de los usos del cobre en estado puro y las tres aleaciones más comunes, que son el bronce, el latón y el cuproníquel. Sin embargo, es importante mencionar que existen muchas otras formas de combinar este metal para darle otros usos.
Creación de cables eléctricos

El cobre empleado para la elaboración de cables está protegido por otro material externo a fin de cuidar su funcionalidad.
El cobre es ampliamente utilizado en la elaboración de cables debido a su propiedad como conductor de electricidad. De allí que gran parte de los cables sean elaborados con un 99,90% de cobre puro.
Elaboración de estatuas

El bronce es utilizado para elaborar estatuas por su resistencia y perdurabilidad. Es una aleación que contiene, al menos, 60% de cobre y 40% de estaño. La adición de estaño proporciona más dureza, evita la corrosión y cambia su color, y es por ello que es utilizado para elaborar estatuas.
El bronce cambia su color dependiendo de la proporción de los metales que lo componen. Si el tono del bronce es más dorado, tiene menos cobre. Si, en cambio, es más rojizo, tiene más cobre.
Vea también Bronce.
Fabricación de instrumentos musicales

Algunos instrumentos musicales de viento, como el saxofón o la trompeta, están hechos de latón. Esta aleación o mezcla contiene aproximadamente 82% de cobre y 18% de zinc, y es conocida por su dureza.
Al igual que en el ejemplo anterior, el color de la aleación es un indicador de su contenido de cobre. Si la aleación es roja, tiene mayor proporción de cobre y menos de zinc; si es dorado, la aleación tiene menos cobre y más zinc.
Elaboración de monedas

Las monedas, como los centavos de dólar, están hechas de cuproníquel, una aleación o mezcla compuesta por cobre y níquel. Las proporciones comúnmente utilizadas para son:
- 90% de cobre y 10 % de níquel
- 70% de cobre y 30% de níquel
El cuproníquel es altamente resistente a la corrosión. Por ello, es también comúnmente utilizado en las tuberías de las plantas desalinizadoras y en las jaulas de acuicultura.
Compuestos químicos con cobre atómico
El cobre atómico puede estar encontrado en combinación con otros elementos como el oxígeno (O), el azufre (S) o el cloro (Cl). A continuación se mencionan ejemplos de estos compuestos químicos y sus usos más comunes.
- El sulfato cúprico [CuSO4], una sal utilizada comúnmente en la industria agrícola como abono y pesticida.
- El óxido cuproso [Cu2O], utilizado como fungicida.
- El cloruro de cobre [CuCl2], utilizado en la industria petrolera como catalizador para eliminar un material corrosivo llamado mercaptano.
- El acetato de cobre [Cu(CH3COO)2], utilizado como catalizador en la industria química.
- Mezclas que contienen óxido cúprico [CuO] entre el 2 y el 10% proporcionan a los azulejos de la cerámica un brillo metálico y tonalidades que van de un verde turquesa a un negro intenso.
La importancia del cobre en la fisiología humana
El cobre es un metal muy importante para el funcionamiento del cuerpo humano. Aun cuando las cantidades que se ingieren parezcan pequeñas, estas son suficientes para generar tejido conectivo y células de la médula ósea como los glóbulos rojos o los macrófagos.
Alimentos destacados en su contenido de cobre son el hígado, ostras, hongos shiitake, nueces, semillas, langostas, vegetales verdes y chocolate negro.
También te puede interesar:
Cómo citar: Rhoton, Stephen (11/04/2024). "Cobre (Cu)". En: Significados.com. Disponible en: https://www.significados.com/cobre-cu/ Consultado:









