Calor
Qué es el calor:
El calor es el proceso de transferencia de energía que fluye entre un sistema y su ambiente a causa de la diferencia de temperatura entre ellos.
Para comprender mejor lo que es el calor usemos la siguiente analogía. El calor es el tráfico de vehículos por una autopista, mientras los vehículos son energía. Si no hay circulación de vehículos, no hay tráfico, así como si no hay transferencia de energía, no hay calor.
La transferencia de energía o calor se establece entre un cuerpo y el ambiente que le rodea cuando existe una diferencia de temperatura. Esta transferencia termina cuando se llega al equilibrio térmico, esto es, cuando la temperatura entre las partes es la misma.
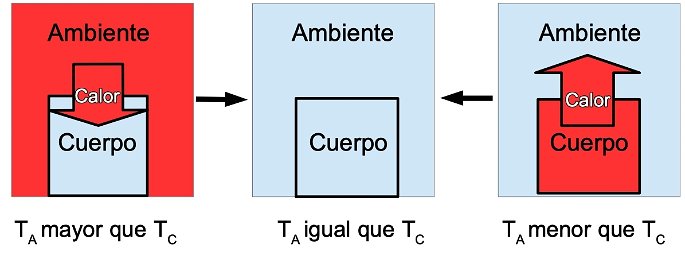
Esquema del calor o la transferencia de energía entre el ambiente y un cuerpo TA es la temperatura del ambiente; TC es la temperatura del cuerpo.
Por ejemplo, cuando metemos una cuchara fría en una taza de té caliente, la cuchara se calienta y el té se enfría hasta que ambos alcanzan la misma temperatura. Hay una transferencia de energía desde el té hasta la cuchara por la diferencia de temperaturas.
Los mecanismos de transferencia de energía como calor son:
- La conducción de calor: ocurre cuando dos partes de una material se mantienen a diferentes temperaturas. Por ejemplo, cuando tocas una olla caliente, se produce una transferencia de energía por conducción de la olla a tu mano.
-
La convección de calor: se produce cuando un fluido circula a través de una diferencia de temperaturas.
Es lo que ocurre al encender el calentador en una habitación: el aire alrededor del calentador se calienta y sube, a la vez que el aire frío baja. - La radiación térmica: se produce cuando el calor se establece entre los cuerpos que no están en contacto, como ocurre entre el Sol y la Tierra.
Calor específico
El calor específico es la cantidad de energía que necesita ser transferida a un kilogramo de una sustancia para aumentar su temperatura en un grado. Esta magnitud física se representa por la letra "c" minúscula y depende del material y de la presión.
Por ejemplo, para subir la temperatura en 1 grado kelvin de 1 kilogramo de agua se necesita transferir 4190 joules, por lo que el calor específico del agua es 4190 Joule/kg.K. Para subir la temperatura en un grado de un kilogramo de hierro hacen falta 462 Joules (c=462 Joule/kg.K).
Esto quiere decir que para calentar el agua hace falta transferir más energía que para calentar la misma cantidad de hierro.
Para hallar el calor específico de una sustancia calculamos su masa (m) y su capacidad calorífica (C), que es la cantidad de calor que puede absorber esta sustancia. La fórmula utilizada es:
Vea más sobre Calor específico.
Calor latente
El calor latente es la cantidad de calor transferido a una unidad de masa de una sustancia para cambiar su estado.
-
Calor latente de fusión: es la cantidad de calor que debe ser transferido para que un sólido pase a líquido; se denota como Lf.
Por ejemplo, el calor latente de fusión del agua es 334 103 J/kg, quiere decir que para derretir 1 kilogramo de agua se requiere la transferencia de 334.103 joules de energía. -
Calor latente vaporización: la cantidad de energía que se debe transferir para que un líquido pase al estado gaseoso; se denota como Lv.
Por ejemplo, el calor latente de vaporización del agua es 2260 103 J/kg, es decir, para evaporar un kilogramo de agua se necesita 2 260 103 J de energía.
Diferencia entre calor y temperatura
No debemos confundir "calor" con "temperatura". Mientras el calor es un proceso donde se transfiere energía, la temperatura es una medida del movimiento interno promedio de los átomos o moléculas de un cuerpo o sustancia. Así, a mayor movimiento interno de las partículas de un material, mayor temperatura.
La temperatura se puede medir en diferentes escalas: kelvin (K), grados Celsius o centígrados (º C), o grados farenheit (ºF). Para medir la temperatura de un cuerpo colocamos el termómetro en contacto con él.
Las unidades para medir el calor son el joule, que es la unidad fundamental de la energía del Sistema Internacional. Sin embargo, en algunos contextos se usa la caloría.
La caloría (cal) se define como la cantidad de energía necesaria para elevar la temperatura de 1 gramo de agua desde 14,5 ºC a 15,5 ºC, específicamente. En este sentido, 1 caloría es igual a 4,186 joules.
Vea también:
Referencias
Beléndez, A. (2017). Calor y temperatura. Fundamentos Físicos de la Ingeniería I. Consultado mayo 2022 en https://rua.ua.es/dspace/bitstream/10045/95287/1/Tema-4-Calor-y-temperatura.pdf
Gómez, A. L. B., & Hernández, A. S. (2010). Detección y clasificación de errores conceptuales en calor y temperatura. Latin-American Journal of Physics Education, 4(2), 21.
Resnick, R., Halliday, D., Krane, K.S. (2013). Física volumen 1, 4ta ed. Grupo Editorial Patria. México.
Cómo citar: (31/05/2022). "Calor". En: Significados.com. Disponible en: https://www.significados.com/calor/ Consultado:




