Compuestos inorgánicos
Los compuestos inorgánicos o moléculas inorgánicas son aquellos que se forman por la combinación de elementos metales y no metales de la tabla periódica. Generalmente, no tienen carbono y, cuando lo tienen, este no constituye un elemento principal.
Reciben este nombre porque no tienen origen biológico. Es decir, son materia inerte que normalmente procede de la corteza terrestre, aunque también se pueden generar a partir de fenómenos naturales.
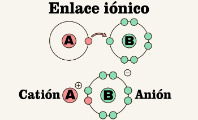
Los compuestos inorgánicos pueden formarse a partir de los elementos metales y no metales mediante enlaces iónicos. Este tipo de enlaces se da por la transferencia de electrones de los metales hacia los no metales. Eventualmente, pueden formarse por enlaces covalentes, los cuales solo se establecen entre elementos no metales. Estos, en vez de transferirse los electrones, los comparten.
Aunque puede decirse que la suma de los elementos metales y no metales representa la mayor parte de la tabla periódica, los compuestos inorgánicos son superados en número por los compuestos orgánicos.
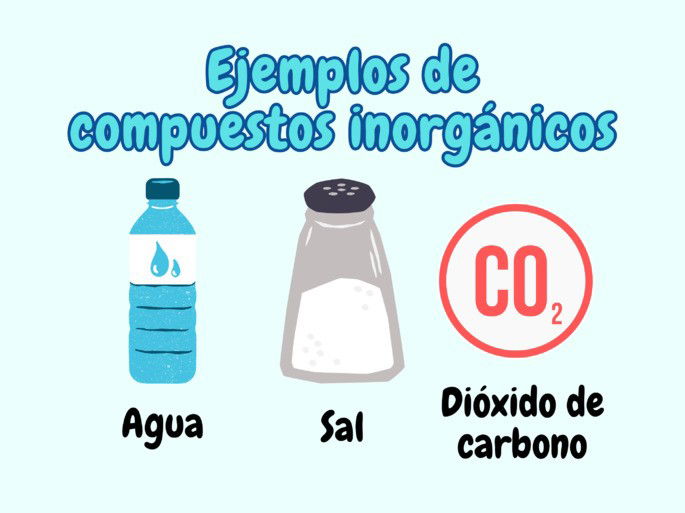
Algunos ejemplos de compuestos inorgánicos en la vida cotidiana son el agua (H₂O); la sal (cloruro de sodio, NaCl); la cal (oxocalcium u óxido cálcico, CaO); el amoniaco (NH3); el dióxido de carbono (CO₂) y el bicarbonato de sodio (NaHCO3).
Características de los compuestos inorgánicos
Los compuestos inorgánicos son muy variados entre sí. Dentro de su variedad, comparten determinadas características que los diferencian de los compuestos orgánicos.
- Resultan de la combinación de los elementos metales y no metales de la tabla periódica.
- Casi siempre se forman por enlaces iónicos.
- Algunos compuestos inorgánicos pueden formarse por enlaces covalentes, como el amoniaco, el agua y el dióxido de carbono.
- No presentan concatenación, es decir, sus enlaces no forman cadenas.
- No presentan isomería, es decir, cada combinación de átomos da lugar a un único compuesto, sin variación en la posición de los mismos.
- Por norma general, no son combustibles.
Propiedades de los compuestos inorgánicos
Las propiedades de los compuestos inorgánicos se refieren al comportamiento de los mismos frente a determinados factores. Las más conocidas son:
Altos puntos de fusión y ebullición: debido a las características de sus enlaces, los compuestos orgánicos presentan puntos de fusión y ebullición muy superiores a los compuestos orgánicos.
Pueden cristalizarse: debido a la falta de movilidad de sus iones, ciertos compuestos inorgánicos tienen la propiedad de la cristalización, es decir, de formar estructuras ordenadas. Por ejemplo, las sales.
Solubilidad en agua: la mayor parte de los compuestos inorgánicos suelen ser solubles en el agua, aunque existen algunas excepciones.
Buena conducción del calor y la electricidad: gracias a que se ionizan, son buenos conductores de electricidad cuando se disuelven en agua. Además, son buenos conductores del calor.
Ver también Enlace iónico.
Tipos de compuestos inorgánicos
La forma más común de clasificar los tipos de compuestos inorgánicos es de acuerdo a sus grupos funcionales.
Óxidos
Reúne a los compuestos formados por la unión del oxígeno con otro elemento. Se subdividen en óxidos básicos y ácidos:
- Óxidos básicos: combinan el oxígeno con un metal por medio de un enlace iónico. Por ejemplo, el óxido de magnesio (MgO), que se usa en la fabricación de antiácidos estomacales.
- Óxidos ácidos: combinan el oxígeno con un no metal mediante enlaces covalentes. Por ejemplo, el monóxido de carbono (CO).
Hidróxidos
Son aquellos que se forman por combinaciones de agua con óxidos básicos. Por ello, en su estructura manifiestan la presencia de OH-. Por ejemplo, el hidróxido de sodio (NaOH), utilizado en la fabricación de textiles, crayones, pinturas y papel.
Ácidos
Surgen de la combinación del hidrógeno con elementos o grupos de alta electronegatividad. Se dividen en:
- Hidrácidos: combinan hidrógeno con un no metal. Su fórmula nunca presenta oxígeno. Por ejemplo, el ácido clorhídrico (HCl).
- Oxácidos: combinan agua con óxido ácido, de modo que su fórmula siempre tiene oxígeno e hidrógeno. Por ejemplo, ácido sulfúrico (H₂SO₄).
Sales
Son aquellas que resultan al combinar un ácido con una base. Dentro de este grupo podemos hablar de:
- Oxisales: combinan ácido oxácido y un hidróxido. Por ende, su fórmula siempre contiene oxígeno, un metal y no metal. Por ejemplo, el nitrato de sodio (NaNO3).
- Sales haloideas: su estructura se compone de un no metal con un metal, y en su proceso de formación se produce agua. Por ejemplo, la sal común, cuyo nombre químico es cloruro de sodio (NaCl).
Hidruros
Suele referir a los compuestos formados por átomos de hidrógeno con cualquier elemento metal o no metal de la tabla periódica. Por ejemplo, hidruro sódico (NaH).
Vea también Ácidos y bases y Recursos naturales.
Ejemplos de compuestos inorgánicos
A continuación, presentamos una lista con ejemplos de compuestos inorgánicos presentes en la vida cotidiana, señalando su origen o sus usos más conocidos.
- Ácido sulfúrico (H2SO4), ácido de baterías para vehículos.
- Ácido clorhídrico (HCl), producido por el estómago para la digestión.
- Agua (H2O), usada en la hidratación de los seres vivos, la higiene, la industria agropecuaria y más.
- Azul de Prusia (Fe4[Fe(CN)6]3), usado como colorante.
- Bicarbonato de sodio (NaHCO3), tiene usos en la cocina, la limpieza y la industria farmacéutica.
- Carbonato de calcio (CaCO3), trata la acidez estomacal.
- Cloruro de bario (BaCl2), componente de los fuegos artificiales.
- Cloruro de sodio (NaCl), sal común.
- Dióxido de azufre (SO2), gas tóxico emanado de las erupciones volcánicas.
- Dióxido de carbono (CO2), gas liberado con la respiración.
- Fosfato de calcio (Ca3[PO4]2), componente de los huesos.
- Hidróxido de sodio (NaOH) o sosa cáustica, componente de los jabones.
- Peróxido de hidrógeno (H2O2) agua oxigenada, usado como agente microbiano y oxidante.
- Monofluorofosfato de sodio (Na2PO3F), componente de las pastas dentales.
- Monóxido de carbono (CO), gas venenoso producido por la combustión de compuestos orgánicos.
- Sulfato de magnesio (MgSO4), conocido como sal de higuera, usado como desinflamante, laxante y broncodilatador.
- Sulfuro de hierro (FeS2), compuesto de las baterías de litio.
- Óxido de zinc (ZnO), componente de cosméticos diversos.
- Óxido nitroso (N2O) o gas de la risa. Tiene un efecto anestésico.
- Yoduro de potasio (KI), entre otros usos, es un protector de la glándula tiroides frente a la radiación.
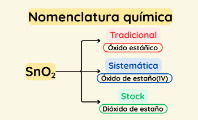
Te puede interesar: Nomenclatura química.
Diferencia entre compuestos orgánicos e inorgánicos
La diferencia principal entre los compuestos orgánicos e inorgánicos está en su origen. Mientras que los compuestos orgánicos tienen un origen biológico, los inorgánicos provienen casi siempre de la corteza terrestre, como el agua. Sin embargo, actualmente pueden obtenerse algunos compuestos orgánicos de manera artificial en laboratorios, como las fibras sintéticas o los plásticos.
Justamente a razón de su origen biológico, las moléculas orgánicas son mucho más numerosas que las inorgánicas.
También se diferencian en el número de elementos que participan. En los compuestos orgánicos solo participan el carbono –cuya presencia es constante–, el hidrógeno, el azufre, el oxígeno, el nitrógeno y el fósforo. En cambio, los compuestos inorgánicos pueden combinar todos los elementos metales y no metales de la tabla periódica.
Los compuestos orgánicos normalmente se forman con enlaces covalentes, mientras que los inorgánicos se forman con enlaces iónicos casi siempre.
Entre las propiedades de los compuestos orgánicos se cuentan combustibilidad, aromaticidad, bajos puntos de fusión y ebullición, solubilidad en disolventes orgánicos y agua. Por último, isomería, esto es, una misma combinación de átomos puede crear diferentes moléculas.
Entre las propiedades de los compuestos inorgánicos podemos reconocer buena conducción del calor y la electricidad, solubilidad en agua y altos puntos de fusión y ebullición.
También te puede interesar: Compuestos orgánicos y Compuestos químicos.
Cómo citar: Significados, Equipo (12/06/2025). "Compuestos inorgánicos". En: Significados.com. Disponible en: https://www.significados.com/compuestos-inorganicos/ Consultado: