Ácidos y bases
En química se llaman ácidos y bases a dos tipos diferentes de sustancias opuestas entre sí. Cada una de estas sustancias reúne propiedades específicas que modifican el comportamiento de las soluciones químicas. Tanto ácidos como bases pueden encontrarse en estado líquido, gaseoso y sólido (el polvo).
Se llaman ácidos a aquellas sustancias que liberan iones de hidrógeno positivos (H+) en una solución. Esta definición fue introducida por el científico Svante Arrhenius. Otro concepto, desarrollado por el científico Gilbert Newton Lewis, define los ácidos como sustancias que pueden recibir o absorber un par de electrones de la solución.
De acuerdo a Svante Arrhenius, se llaman bases a aquellas sustancias que pueden captar iones de hidrógeno en solución o liberan iones negativos, llamados hidroxilos (OH-). También se definen las bases como aquellas sustancias que aportan dos electrones a la solución, siguiendo la teoría de Gilbert Newton Lewis.

Los ácidos y bases interactúan con la materia de formas diferentes. Por ejemplo, los ácidos pueden ser corrosivos para el ser humano, mientras que las bases son menos dañinas, pero pueden provocar irritación o problemas respiratorios. Otro elemento a destacar es que tanto los ácidos como las bases son capaces de conducir electricidad.
Al juntarse ácidos y bases en una solución, se produce una reacción exotérmica, es decir, se produce calor. Esta reacción se conoce como neutralización, de la que se forman agua y diferentes tipos de sales.
Características de los ácidos y bases
Los ácidos presentan un pH que oscila entre 0 y 7, siendo 7 el pH neutro. Es decir, mientras más bajo sea el pH, más ácida será la sustancia y más iones de hidrógeno (H+) liberará. Además, estas sustancias suelen ser insolubles en agua.
Otra característica de los ácidos es que son conductores de electricidad. La energía eléctrica fluye fácilmente a través de la sustancia gracias a los iones que producen los ácidos.
Los ácidos producen reacciones al interactuar con ciertos metales, generando hidrógeno y sales. Asimismo, también pueden reaccionar con bases u óxidos metálicos, formando moléculas de agua y sales.
Interactuar con grandes cantidades de ácidos es desaconsejable, pues poseen la capacidad de destruir tejidos orgánicos. En aquellos con poca capacidad corrosiva, uno puede percibir un sabor agrio.
Las bases presentan un pH que oscila entre 7 y 14, siendo 14 el equivalente a las sustancias más básicas o alcalinas. Mientras más básica sea la base, liberará más hidroxilos (OH-). Bastantes de estas bases tienen la propiedad de ser insolubles en agua.
En el caso de las bases, estas pueden conductores de electricidad si se hallan diluidas en disoluciones acuosas. De lo contrario, no presentan esa propiedad como lo hacen los ácidos. No reaccionan con los metales, pero sí con los ácidos, produciendo agua y sales.
Las bases son menos peligrosas, ya que no corroen los tejidos orgánicos. Sin embargo, sí pueden corroer metales e irritan la piel porque disuelven la grasa. Las bases resultan jabonosas en el tacto y tienen un sabor amargo al gusto.
Tipos de ácidos y bases
Tanto los ácidos como las bases se clasifican en dos tipos: en fuertes y débiles. El criterio para nombrar un ácido o una base como un tipo u otro varía.
En los ácidos, por ejemplo, podemos hablar de los siguientes tipos:
Ácido fuerte: es aquel que cede todos o la mayor parte de sus iones de hidrógeno en solución, lo que quiere decir que se ioniza con gran facilidad. Por ejemplo, el HCl o ácido clorhídrico.
Ácido débil: al contrario del anterior, el ácido débil en solución acuosa libera iones H+ en menor proporción. Por ejemplo, el ácido acético.
En el ámbito de las bases, los criterios para clasificarlas como fuertes o débiles son los siguientes:
Base fuerte: se refiere a una variedad de electrolito al que se le atribuye un carácter fuerte y que, por lo tanto, puede ionizarse totalmente en una solución acuosa. Por ejemplo, la soda cáustica.
Base débil: se refiere a aquellas bases que no se disocian totalmente en la solución acuosa, de lo que resulta la presencia de un ion OH más el radical básico. Por ejemplo, el amoniaco o hidróxido de amonio.
Ejemplos de ácidos y bases
Como ejemplos de ácidos en la vida cotidiana podemos mencionar los siguientes:
- ácido acético o CH3COOH, como en el vinagre;
- ácido ascórbico o C6H8O6, presente en la vitamina C;
- ácido fosfórico o H3PO4, presente en las bebidas gaseosas;
- ácido láctico o C3H6O3, producido durante el ejercicio físico;
- ácido cítrico o C6H8O7, que se encuentra en naranjas, toronjas, limones, mandarinas, etc.
Como ejemplo de bases en la vida cotidiana podemos mencionar los siguientes:
- hidróxido de sodio o NaOH, como en la soda cáustica;
- hidróxido de potasio o KOH, uno de los componentes de los jabones;
- hidróxido de aluminio o Al(OH)3, un antiácido estomacal;
- hidróxido de magnesio o Mg(OH)2, presente en la leche de magnesia;
- hidróxido de calcio o CaOH, que se halla en la cal.
Vea también Nomenclatura química.
Diferencias entre ácidos y bases
Una de las diferencias más importantes entre ácidos y bases es que los ácidos captan electrones de la solución en la que están disueltos, mientras que las bases los aportan. Asimismo, los ácidos liberan iones positivos de hidrógeno, mientras que las bases liberan hidroxilos.
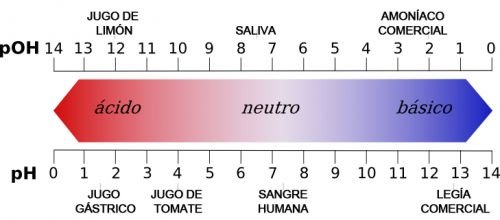
Otra diferencia es la forma de medir la capacidad de liberar iones de hidrógeno o hidroxilos. Para saber cuán ácida o básica es una sustancia, se suele emplear la escala de pH (en el caso de los ácidos) o la escala de pOH (para las bases). Por ejemplo, mientras más bajo sea el valor del pH, más ácida será la sustancia; mientras más bajo sea el pOH, más básica o alcalina será.
Debido a estas diferencias, ácidos y bases producen efectos diversos en las soluciones químicas. Por ejemplo, en las pruebas de pH se acostumbra usar papel tornasolado. El papel tornasolado azul adquiere tonalidades cálidas al contacto con ácidos, es decir, adquiere tonos rosas o rojos según la intensidad.
Por el contrario, cuando una base reacciona con un papel tornasolado rojizo, este adquiere tonalidades azules.
Cómo citar: Rhoton, Stephen (02/04/2025). "Ácidos y bases". En: Significados.com. Disponible en: https://www.significados.com/acidos-y-bases/ Consultado: