Metal
Un metal es un elemento químico con la capacidad de conducir calor y electricidad. Se caracteriza también por tener una densidad alta en comparación con elementos no metales, y por reflejar luz, lo que a su vez le aporta brillo.
Algo que diferencia los metales de otros elementos es la manera en que se enlazan los átomos. Los átomos de un metal están fuertemente unidos entre sí, bien compactos, cuando están en su forma pura. Al combinarse con elementos no metálicos, los metales ceden electrones, convirtiéndose así en cationes o iones electropositivos.
Algunos ejemplos de metales son el oro, la plata, el plomo y el cobre. Dependiendo del metal, unos serán más densos que otros, o tendrán distintos puntos de fusión y ebullición. Algunos incluso son radiactivos, como el uranio y el plutonio.

Los metales se encuentran en la naturaleza en estado sólido, a excepción del mercurio, que se halla en estado líquido. Los podemos encontrar en abundancia en la corteza terrestre y extraerlos en sus formas puras. Sin embargo, al entrar en contacto con el oxígeno o algunos tipos de ácidos, se pueden oxidar y corroer.
Los metales forman parte de los elementos ampliamente utilizados por los seres humanos. Durante miles de años, los metales han sido aprovechados en su estado natural para la elaboración de herramientas básicas.
Luego, con el desarrollo tecnológico, los metales cobraron mayor importancia en nuestra vida diaria. Hoy en día, son de los elementos más importantes en la producción industrial, especialmente por su resistencia y ser conductores de calor y electricidad.
En resumen, los metales sirven para la elaboración de vehículos, artículos de cocina, la construcción, cables eléctricos, dispositivos electrónicos, etc.
Metales en la tabla periódica
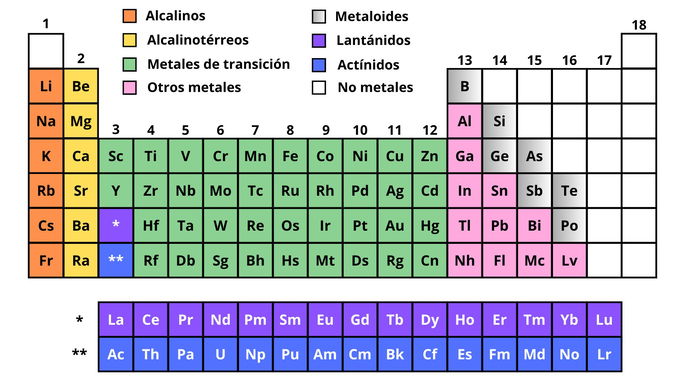
Hay 91 metales identificados en la tabla periódica, agrupados según sus características. Los grupos o tipos de metales son: alcalinos, alcalinotérreos, metales de transición, lantánidos, actínidos y otros metales. También existen los metaloides, que son elementos con características y propiedades que no encajan completamente como metal ni no metal.
Metales alcalinos
Son elementos muy reactivos en condiciones de presión y temperatura estándar. Por ello, es difícil hallarlos sin estar enlazados con otros elementos. Además, presentan brillo, son muy buenos conductores de la electricidad y calor, y suelen ser menos densos y más blandos respecto a otros metales.
Los metales alcalinos son: litio (Li), sodio (Na), potasio (K), rubidio (Rb), cesio (Cs) y francio (Fr).
Metales alcalinotérreos
Los metales alcalinotérreos, comparados con los alcalinos, presentan mayor dureza y menor reactividad. No obstante, siguen siendo buenos conductores del calor y la electricidad, y poseen una densidad baja.
Los metales alcalinotérreos son: berilio (Be), magnesio (Mg), calcio (Ca), estroncio (Sr), bario (Ba) y radio (Ra).
Metales de transición
Los metales de transición son el grupo más grande de metales en la tabla periódica, abarcando 38 elementos. La mayoría de estos metales son duros, buenos conductores de calor y electricidad, y con puntos de fusión y ebullición bastante elevados.
Ejemplos de metales de transición son el titanio (Ti), cromo (Cr), hierro (Fe), cobre (Cu), plata (Ag), platino (Pt), oro (Au) y mercurio (Hg).
Lantánidos
Los lantánidos o tierras raras agrupa metales bastante parecidos entre sí. Una característica que los define es que se encuentran en la naturaleza en forma de óxidos. Son además metales pesados con propiedades magnéticas y espectrales.
Junto con los actínidos, los lantánidos son considerados elementos de transición interna. Los elementos de transición interna son aquellos llamados de bloque f, por el hecho de tener sus electrones de valencia en el orbital f.
Algunos lantánidos son el lantano (La), neodimio (Nd), prometio (Pm), europio (Eu) y lutecio (Lu).
Actínidos
Igual que los lantánidos, los actínidos forman parte del grupo de elementos de transición interna. Muchos de los representantes de este grupo son altamente radioactivos; por esa razón, es difícil hallarlos en la naturaleza.
Ejemplos de actínidos son el actinio (Ac), uranio (U), americio (Am), einstenio (Es) y laurencio (Lr).
Otros metales
Aquí se agrupan los metales que no encajan en los demás grupos, pero siguen poseyendo características propias de un metal. Por ejemplo, son buenos conductores de calor y electricidad. En general, los considerados otros metales tienden a ser blandos y poseen unos puntos de fusión y ebullición más bajos respecto a otros.
En este grupo podemos encontrar el aluminio (Al), estaño (Sn), plomo (Pb), bismuto (Bi) y livermorio (Lv), entre otros.
Metaloides
También llamados semimetales, este grupo contiene 7 elementos. Aunque no son metales en el sentido estricto, sí poseen algunas características y propiedades parecidas a ellos.
Los metaloides son el boro (B), silicio (Si), germanio (Ge), arsénico (As), antimonio (Sb), telurio (Te) y polonio (Po).
Otros tipos de metales
Existen otras formas de clasificar a los metales, como los metales preciosos, ferrosos, básicos o no ferrosos, radiactivos y aleaciones. Veamos uno por uno cuáles son estos tipos.
Metales preciosos

Los metales preciosos son el oro, la plata y el platino. Estos tres metales se caracterizan por tener un alto valor económico y ser ampliamente usados para la elaboración de joyas y piezas de orfebrería. Se pueden encontrar en estado libre en la naturaleza y no están aleados con otros metales.
Metales ferrosos
Los metales ferrosos son aquellos que tienen como base o elemento principal el hierro. Se caracterizan por ser pesados, corroerse con facilidad, ser de color gris y tener propiedades magnéticas. A pesar de las desventajas, estos metales son de los más utilizados en la actualidad.
Como ejemplo podemos mencionar el hierro puro, el acero y otras mezclas y fundiciones que contienen hierro. Muchos de estos metales se utilizan en la construcción de puentes, vigas, carrocerías, cerraduras, herramientas, piezas de unión, entre otros.
Metales básicos
Los metales básicos o no ferrosos son aquellos que no tienen como elemento base el hierro. Bastantes de ellos son metales blandos y tienen poca resistencia mecánica. Dentro de esta categoría podemos diferenciar entre metales pesados (estaño o cobre) o livianos (aluminio o titanio).
El aluminio es uno de los metales no ferrosos más utilizados. Posee una buena resistencia a la corrosión, es conductor eléctrico y tiene una alta relación resistencia-peso.
Otros metales no ferrosos importantes son el cobre, estaño, zinc, plomo, níquel y el manganeso, entre otros. Estos metales se emplean para la fabricación de automóviles, aviones, cables eléctricos, tuberías, bobinas de motores, etc.
Metales radioactivos
Los metales radioactivos son aquellos que emiten radiación en su estado natural. Algunos ejemplos son el plutonio, uranio y torio. Se encuentran en pequeñas cantidades sobre la corteza de la Tierra y son extraídos a través de diversas actividades humanas como la minería y la extracción de gas o petróleo.
Los metales radioactivos han sido empleados en áreas de la minería, medicina o agricultura, así como para la guerra.
Aleaciones
Las aleaciones son mezclas de metales en diferentes proporciones, aunque también pueden ser mezclas entre un metal y un no metal. Estas mezclas incluyen elementos que se combinan sin reaccionar. A raíz de esto, las propiedades de una aleación son el resultado de la combinación de las propiedades de los elementos mezclados.

Ejemplos de aleaciones son el acero, una combinación de hierro y carbono; bronce, una mezcla de cobre y estaño; y latón, que combina cobre y zinc.
Vea también Bronce, Cobre y Acero.
Propiedades de los metales
Las propiedades más destacables de los metales son:
- Maleabilidad: capacidad de los metales para extenderse en láminas o planchas al pasar por un proceso de compresión.
- Ductilidad: propiedad de ciertos metales que les permite ser moldeados y extendidos en forma de hilos o alambres.
- Tenacidad: es la capacidad que poseen los metales para soportar golpes sin romperse.
- Resistencia mecánica: capacidad que poseen los metales para resistir la torsión, la flexión, la tracción o la comprensión sin deformarse o romperse.
- Baja electronegatividad: los metales tienden a ceder electrones en vez de ganarlos. Por ello, a la hora de enlazarse con otros elementos, suelen estar en forma de cationes.
Vea también Propiedades de los metales.
Características de los metales
Los metales poseen diferentes características, entre las que destacan las siguientes:
- Conductividad: los metales son buenos conductores de electricidad, por lo que son ampliamente utilizados en la fabricación de cableados, entre otros.
- Color: los metales suelen ser de color grisáceo, sin embargo, en los casos de los metales puros se pueden observar otros colores como el amarillo en el oro, el rosado en el bismuto o el rojizo en el cobre.
- Elevada densidad: un metal suele ser bastante denso respecto a otros elementos de la tabla periódica debido a la fuerte unión y poca distancia entre los átomos de un mismo elemento metálico.
- Reutilización y reciclaje: un gran número de los metales pueden ser reciclados y reutilizados, por lo que se pueden aprovechar más de una vez y evitar un mayor porcentaje de contaminación ambiental.
Vea también Características de los metales y No metales.
Cómo citar: Rhoton, Stephen (05/02/2024). "Metal". En: Significados.com. Disponible en: https://www.significados.com/metal/ Consultado:







