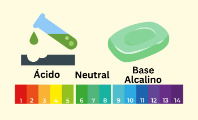
Ácido
Un ácido es un compuesto químico que libera o cede iones de hidrógeno (H+) en solución acuosa. Cuando el ácido se disuelve en agua, en la solución se forman iones hidronio (H3O+) en mayor o menor medida según el tipo de ácido.
Existen tres teorías que definen qué es un ácido:
- la teoría de Arrhenius, que define un ácido como una sustancia que, al disolverse en agua, cede iones de hidrógeno y en la solución aumenta la concentración de cationes hidronios (H3O+);
- la teoría de Brønsted-Lowry, que define un ácido como una sustancia capaz de ceder protones, sea en un medio acuoso o no acuoso;
- y la teoría de Lewis, que define un ácido como aquella sustancia que recibe dos electrones.
En la escala del pH, un ácido es aquel cuyo pH se ubica entre 0 (muy ácido) y 7 (neutro), aunque hay casos en los que el pH del ácido es negativo por su elevada acidez.

El concepto de los ácidos surgió por primera vez en 1884, cuando el químico sueco Svante Arrhenius clasificó compuestos como ácidos o bases según el tipo de iones que se forman en solución.
Para saber si una sustancia es ácida, se suele utilizar una tira de papel de tornasol o un indicador que cambia de color en presencia de ácidos. Existen otros métodos más precisos para saber la cantidad exacta, como la valoración o neutralización, en el que se emplea una sustancia de concentración conocida que reacciona con el ácido.
Los ácidos son útiles en diferentes ámbitos. Por ejemplo, algunos sirven para la creación de fertilizantes que enriquecen el suelo; para catalizar reacciones químicas de forma controlada; para conducir energía eléctrica en baterías; llevar a cabo la digestión de alimentos; o eliminar impurezas en sustancias metálicas.
Ejemplos de ácidos
Existen diversos ácidos que se utilizan en el día a día en diferentes ámbitos y sectores, como:
- Ácido clorhídrico (HCl): es una sustancia corrosiva utilizada como reactivo químico.
- Ácido sulfúrico (H2SO4): es uno de los compuestos químicos más corrosivos.
- Ácido nítrico (HNO3): se utiliza para fabricar fertilizantes y como reactivo para análisis de laboratorio.
- Ácido fosfórico (H3PO4): es uno de los componentes de los materiales de restauración dental y de las gaseosas.
- Ácido oxálico ( H2C2O4): está presente en productos de limpieza de piso, maderas y para eliminar el óxido.
- Ácido acético (CH3COOH): está presente en el vinagre, y también se usa como base para textiles como el rayón y el nailon.
- Ácido tartárico (C4H6O6): un ácido que se halla en diversos alimentos, como en los cítricos y las uvas, y se emplea en ocasiones como regulador de pH.
- ADN y ARN: son dos tipos de biomoléculas que contienen la información genética del organismo y que permiten la síntesis de proteínas.
También hay diversos alimentos conocidos por su alta acidez. Por ejemplo, los cítricos como los limones, limas, naranjas, mandarinas o pomelos contienen un elevado nivel de acidez que podemos detectar fácilmente por el gusto agrio que tienen.
Otros alimentos ácidos a destacar son el café, las bebidas alcohólicas, las uvas, las bebidas carbonatadas, la carne roja y el queso.
Por último, un ejemplo a destacar es el ácido gástrico que hay en el estómago del ser humano. Esta sustancia nos permite realizar la digestión de alimentos, rompiendo moléculas para que los nutrientes sean fáciles de asimilar.
Características de los ácidos
- Su nivel de pH es inferior a 7. El pH mide la concentración de iones (H+) o hidronios (H3O+) en una solución. A menor pH, mayor es la acidez de la sustancia. En ocasiones, el pH puede ser menor de 0, indicando así un compuesto químico con elevada acidez.
- Son conductores de energía eléctrica, es decir, este tipo de energía fluye con facilidad a través de los iones que se forman cuando los ácidos reaccionan con otras sustancias. Por ejemplo, cuando introducimos ácidos en un medio acuoso, la solución se torna conductora de electricidad.
- Los ácidos, al reaccionar con metales, generan hidrógeno (H) y sal. Asimismo, al reaccionar con bases o con óxidos metálicos, se neutralizan y generan agua (H₂O) y sales.
- Algunos son corrosivos al contacto con la piel. Por ejemplo, el ácido clorhídrico (HCl), conocido como ácido muriático, puede causar destrucción de los tejidos, por lo que se considera un material de uso controlado.
- Hay ácidos que no son peligrosos para el ser humano, e incluso pueden ser útiles, como los alimentos que contienen sustancias ácidas.
- En los alimentos comestibles que presentan acidez, suelen tener un sabor agrio o ácido, especialmente en las frutas cítricas.
- Son solubles en agua, es decir, que se disocian o se disuelven en agua con facilidad. No obstante, el nivel de disociación dependerá de si se trata de un ácido fuerte o de un ácido débil.
- Los ácidos se suelen hallar en estado líquido o gas; en pocos casos, también pueden estar en estado sólido.
Ver también pH.
Tipos de ácidos
Ácidos fuertes y débiles
Los ácidos se clasifican principalmente en dos grandes grupos según su capacidad de ionización: en ácidos fuertes y ácidos débiles.
Ácidos fuertes
Son aquellos compuestos capaces de liberar iones de hidrógeno (H+) o de formar iones hidronio (H3O+) con facilidad en una solución. Se caracterizan por ser generalmente muy corrosivos, por disociarse total o mayoritariamente en una solución acuosa, y tener la capacidad de conducir la energía eléctrica de forma eficiente.
Ejemplos de ácidos fuertes son el ácido clorhídrico (HCI), el ácido bromhídrico (HBr), y el ácido sulfúrico (H2SO4) hasta disociarse por primera vez.
Ácidos débiles
Son los compuestos químicos que no liberan iones de hidrógeno (H+) ni forman iones hidronio (H3O+) en gran cantidad. Por ello, se caracterizan por ser menos corrosivos y nunca se disocian totalmente en una solución acuosa.
Ejemplos de ácidos débiles son el ácido hipobromoso (HBrO), el ácido carbónico (H2CO3) y el ácido sulfúrico cuando se disocia por segunda vez.
Ácidos orgánicos e inorgánicos
Esta forma de clasificar los ácidos los agrupa según si son moléculas orgánicas o no.
Por un lado, los ácidos orgánicos son aquellos que contienen átomos de carbono. Algunos ejemplos de este tipo de ácidos son el ácido láctico (C3H6O3), el ácido acético (CH3COOH) y el ácido oxálico ( H2C2O4).
Por el otro lado, los ácidos inorgánicos son los que no poseen átomos de carbono. Ejemplos de estos ácidos son el ácido clorhídrico (HCl), el ácido sulfúrico (H2SO4) y el ácido nítrico (HNO3).
Vea también:
Cómo citar: Rhoton, Stephen (11/06/2025). "Ácido". En: Significados.com. Disponible en: https://www.significados.com/acido/ Consultado: