Base
En química, base se refiere a una sustancia que al estar en una disolución acuosa libera iones hidroxilo (OH-), aumentando sus propiedades alcalinas.
La base en química es también una sustancia capaz de aceptar protones (teoría de Brønsted-Lowry), o que puede ceder un par de electrones (teoría de Lewis). En medios no acuosos, una base también puede liberar iones hidroxilos si reacciona con otras sustancias, como un ácido.

Un ejemplo de una base en química son los jabones. Debido a sus propiedades y reactividad con el agua y otros compuestos, los jabones nos ayudan en la labor de lavar nuestras manos o los platos y cubiertos.
Inicialmente, las bases se conocían como álcalis, ya que es una sustancia que aumenta el pH de una solución al liberar hidroxilos. Por tanto, la alcaliniza. Su nombre deriva del árabe Al-Qaly, que se traduce como ‘ceniza’.
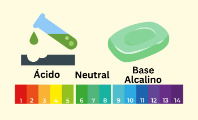
Las sustancias que tienen un nivel de pH superior a 7 hasta 14 (nivel máximo) son consideradas como bases y tendrán mayor alcalinidad. Por el contrario, las sustancias con un pH entre 0 y 7 son consideradas ácidos.
Fue a partir del siglo XIX que se pudo comprender mejor qué es una base y un ácido a partir de los estudios realizados por los científicos Svante August Arrhenius (1887), Johannes N. Brønsted y Thomas M. Lowry (1923, teoría ácido-base), y Gilbert N. Lewis (1923).
Características de las bases
Entre las principales características de las bases se pueden mencionar las siguientes:
- El pH de una base oscila entre 7 y 14, en el que las bases poco alcalinas son próximas a 7, y las bases más alcalinas, cercas de 14.
- Según la temperatura, las bases pueden encontrarse en sustancias líquidas, sólidas o gaseosas.
- Se pueden clasificar en bases fuertes o bases débiles según su disociación, es decir, su capacidad de aportar iones OH-.
- Tienen un sabor amargo.
- Puede haber bases que conserven sus propiedades en sustancias puras o diluidas.
- En disoluciones acuosas, pueden ser conductores de electricidad.
- En el tacto resultan jabonosas.
- Son corrosivas en diversos metales.
- Forman sales y agua al combinarse con los ácidos.
- Al olerlos pueden generar irritaciones.
- Pueden resultar irritantes en la piel porque disuelven la grasa.
Ejemplos de bases
Las bases son ampliamente utilizadas en diversos tipos de industria, generalmente, como catalizador o reactivos. De allí que se empleen en la industria alimenticia, médica, química, manufacturación de jabones y disolventes, manufacturación de baterías eléctricas, entre otras.
Algunos ejemplos de bases son:
- Soda cáustica (NaOH).
- Bicarbonato de sodio (NaHCO3, desodorante).
- Amoníaco (NH3).
- Hidróxido de magnesio (Mg(OH)2, laxante o leche de magnesia).
- Hidróxido de calcio (CaOH, cal).
- Hipoclorito de sodio (NaCIO, cloro de limpieza).
- Hidróxido de potasio (KOH, jabón).
- Hidróxido de hierro II (Fe(OH)2) o hierro III (Fe(OH)3).
- Hidróxido de cobre (Cu(OH)2).
Tipos de bases
Existen dos tipos de bases, que son las bases fuertes y las bases débiles.
Base fuerte: es aquella que se disocia completa o mayoritariamente en el agua y aporta un mayor número de iones hidroxilos (OH-). Por ejemplo, el hidróxido de sodio (NaOH) o el hidróxido de potasio (KOH).
Base débil: aporta iones OH- en menor cantidad con respecto a las bases fuertes, y nunca se disocian completamente. Dos ejemplos son el amoniaco (NH3) o el hidróxido de amonio (NH4OH).
Nomenclaturas básicas
Las nomenclaturas de las bases se forman a partir del nombre del elemento que se junta con el ion de hidroxilo (OH), se toma el número de valencia y se combinan. Por ejemplo: CuOH2: hidróxido de cobre, Zn(OH)2: hidróxido de zinc.
Vea también Ácidos y bases, Óxido.
Cómo citar: Rhoton, Stephen (10/06/2025). "Base". En: Significados.com. Disponible en: https://www.significados.com/base/ Consultado: