Ejercicios sobre modelos atómicos
Pon a prueba tus conocimientos con ejercicios de dificultad baja, media y alta sobre los modelos atómicos propuestos por Dalton, Thomson, Rutherford y Niels Bohr, entre otros.
Ejercicio 1 (nivel fácil)
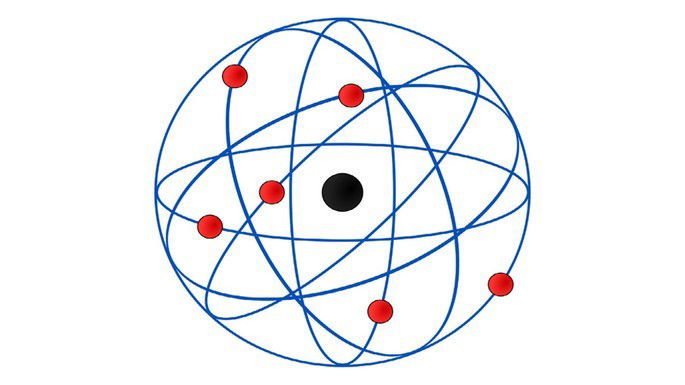
¿Qué modelo atómico representa la siguiente imagen?
Ejercicio 2 (nivel fácil)
¿Qué científico propuso el primer modelo atómico, conocido como “bola de billar”?
a) Isaac Newton.
b) Demócrito.
c) John Dalton.
d) Ernest Rutherford.
Ejercicio 3 (nivel fácil)
Señala la alternativa incorrecta:
a) Las primeras ideas sobre la estructura interna de los átomos fueron de Thomson.
b) En el modelo atómico de Rutherford-Bohr, los electrones giran alrededor del núcleo, pero no al azar, sino describiendo órbitas determinadas.
c) El modelo atómico de Dalton considera la existencia de cargas en los átomos.
d) Demócrito y Leucipo fueron los primeros en definir el concepto de materia y átomo.
Ejercicio 4 (nivel fácil)
Clasifica cada una de las afirmaciones que figuran a continuación sobre el modelo atómico de Rutherford como Verdadera o Falsa.
I. El Modelo Atómico de Rutherford sugiere que el átomo se parece a un pequeño sistema planetario.
II. El Modelo Atómico de Rutherford es conocido como “modelo pudin de ciruelas” o “pudin con pasas” por la forma en que las cargas positivas y negativas están organizadas.
III. En el Modelo Atómico de Rutherford, el núcleo está formado por los protones y neutrones, y los electrones giran a su alrededor de la misma forma que los planetas gira en torno al Sol.
IV. El Modelo Atómico de Rutherford es también llamado “Modelo Atómico de Rutherford-Bohr”.
Ejercicio 5 (nivel fácil)
Los modelos atómicos describen algunos aspectos estructurales de los átomos. Escoge la respuesta correcta sobre los modelos atómicos.
a) Los modelos atómicos fueron desarrollados por los científicos griegos Leucipo y Demócrito.
b) Los principales modelos atómicos son: el Modelo de Rutherford y el Modelo de Rutherford-Bohr.
c) El primer modelo atómico que se desarrolló fue el Modelo Atómico de Rutherford.
d) Los modelos atómicos fueron desarrollados con el objetivo de comprender mejor los átomos, sus propiedades y su influencia en el comportamiento de la materia.
Ejercicio 6 (nivel medio)
Relaciona las siguientes afirmaciones con sus respectivos creadores:
I - El átomo no es indivisible y la materia tiene propiedades eléctricas (1897).
II - El átomo es una esfera maciza (1808).
III - El átomo está formado por dos regiones denominadas núcleo y electrosfera (1911).
a) I - Dalton, II - Rutherford, III - Thomson.
b) I - Thomson, II - Rutherford, III - Dalton.
c) I - Dalton, II - Thomson, III - Rutherford.
d) I - Rutherford, II - Dalton, III - Thomson.
e) I - Thomson, II - Dalton, III - Rutherford.
Ejercicio 7 (nivel medio)
Considera las siguientes afirmaciones sobre el modelo atómico de Rutherford-Bohr.
I. La mayor parte del volumen del átomo está constituida por un núcleo denso y positivo.
II. Los electrones se mueven en órbitas estacionarias alrededor del núcleo.
III. El electrón, al saltar de una órbita más externa a una más interna, emite una cantidad de energía bien definida.
¿Cuáles son verdaderas?
a) Solo I.
b) Solo II.
c) Solo III.
d) Solo II y III.
e) Las tres son verdaderas.
Ejercicio 8 (nivel medio)
En 1913, Niels Bohr propuso un modelo para la estructura de los átomos que explicaba el origen de los espectros atómicos. Este modelo incluía una serie de postulados, entre ellos uno que establecía que la energía del electrón solo puede asumir ciertos valores discretos. Esto hacía que los electrones orbitasen alrededor del núcleo ocupando únicamente las órbitas que contenían los niveles de energía permitidos.
Teniendo en cuenta este modelo de Bohr, los diferentes espectros atómicos pueden explicarse en función de:
a) solamente la emisión de energía de electrones cuando bajan de nivel energético.
b) solamente la absorción de energía de los electrones cuando suben de nivel energético.
c) las diferentes transiciones electrónicas cuando los electrones emiten o absorben energía, que varían de un elemento a otro.
d) la recepción o pérdida de electrones por diferentes elementos.
Ejercicio 9 (nivel medio)
La aceptación histórica de la idea de que la materia está compuesta por átomos fue lenta y gradual. En la antigua Grecia, Leucipo y Demócrito son recordados por haber introducido el concepto de átomo, pero sus propuestas fueron rechazadas por otros filósofos y cayeron en el olvido. A finales del siglo XVIII y principios del siglo XIX, cuando las ideas de Lavoisier ganaban aceptación generalizada, surgió la primera teoría atómica moderna, propuesta por _______.
Esta teoría postulaba que los elementos estaban constituidos por un único tipo de átomo, mientras que las sustancias compuestas eran combinaciones de diferentes átomos en proporciones determinadas. Casi cien años después, estudios con rayos catódicos llevaron a J. J. Thomson al descubrimiento del _______, una partícula de masa muy pequeña y carga eléctrica _______, presente en todos los materiales conocidos.
Algunos años después, mediante experimentos en los que una fina lámina de oro fue bombardeada con partículas alfa, Rutherford llegó a la conclusión de que el átomo tiene en su centro un _______ pequeño, pero de masa considerable.
Las palabras que completan correctamente las lagunas son:
a) Dalton – electrón – negativa – núcleo
b) Bohr – catión – positiva – electrón
c) Dalton – neutrón – neutra – protón
d) Bohr – fotón – negativa – anión
e) Dalton – protón – positiva – núcleo
Ejercicio 10 (nivel medio)
El átomo de Rutherford (1911) se comparó con el sistema planetario, en el que el núcleo atómico representa el sol, y la electrosfera, los planetas.
Electrosfera es la región del átomo que:
a) contiene los neutrones.
b) contiene protones y neutrones.
c) contiene las partículas de carga eléctrica positiva.
d) contiene las partículas de carga eléctrica negativa.
e) concentra prácticamente toda la masa del átomo.
Ejercicio 11 (nivel difícil)
Considerando los modelos atómicos más relevantes, dentro de una perspectiva histórica y científica, marque la opción correcta.
a) En el modelo atómico de Dalton, el átomo se consideraba indivisible. El modelo sucesor fue el de Rutherford, en el cual el átomo estaba constituido por un núcleo con carga negativa y una corteza electrónica.
b) Hasta el descubrimiento de la radiactividad, el átomo se consideraba indivisible (Dalton). El modelo que lo sucedió fue el de Thomson, que proponía que el átomo estaba formado por una masa cargada positivamente con los electrones distribuidos en ella.
c) En el modelo de Dalton, el átomo estaba constituido por un núcleo con carga positiva y una corteza electrónica. El modelo siguiente fue el de Bohr, que introdujo la idea de que los electrones ocupan órbitas con energías definidas, similar al modelo del sistema solar.
d) El modelo de Dalton proponía que el átomo estaba formado por una masa cargada positivamente con los electrones distribuidos en ella. El modelo siguiente fue el de Rutherford, en el cual el átomo estaba compuesto por un núcleo con carga positiva y una corteza electrónica.
e) En el modelo atómico de Dalton, los electrones ocupaban órbitas con energías definidas, similar al modelo del sistema solar. El modelo que lo sucedió fue el de Thomson, que proponía que el átomo estaba formado por una masa cargada positivamente con los electrones distribuidos en ella.
Ejercicio 12 (nivel difícil)
El modelo propuesto por Bohr introdujo un único número cuántico para describir el comportamiento del electrón en el átomo. El modelo de la mecánica cuántica utiliza tres números cuánticos.
Sobre los números cuánticos propuestos en el modelo de Bohr y en el modelo de la mecánica cuántica, es CORRECTO afirmar que:
a) El modelo atómico de Bohr está relacionado con un número cuántico que describe la orientación de los orbitales.
b) El número cuántico azimutal tiene valores positivos y enteros, y a medida que este número cuántico aumenta, el orbital se vuelve más grande.
c) El nivel con el número cuántico principal n consistirá en n subniveles, y cada subnivel corresponde a un valor permitido diferente del número cuántico secundario entre 1 y n - 1.
d) Las energías relativas del electrón en los orbitales del átomo de hidrógeno tienen valores diferentes cuando el electrón está en orbitales del mismo subnivel.
Ver también:
Cómo citar: (13/05/2025). "Ejercicios sobre modelos atómicos". En: Significados.com. Disponible en: https://www.significados.com/ejercicios-sobre-modelos-atomicos/ Consultado: