Modelos atómicos
Un modelo atómico es una representación o interpretación sobre la estructura y composición del átomo. Nos permite entender cómo está formada la materia y de qué manera interaccionan sus partículas.
Desde Demócrito hasta la actualidad, han surgido varios modelos atómicos a lo largo de los siglos. Gracias a ejercicios de razonamiento y experimentos científicos, el átomo ha pasado de ser una simple esfera pequeña a algo mucho más complejo.
Hoy en día se conoce que el átomo está compuesto por varias partes, pero, ¿cómo se ha llegado al modelo actual? Veamos a continuación cómo han evolucionado los modelos atómicos con el paso del tiempo.
Evolución de los modelos atómicos
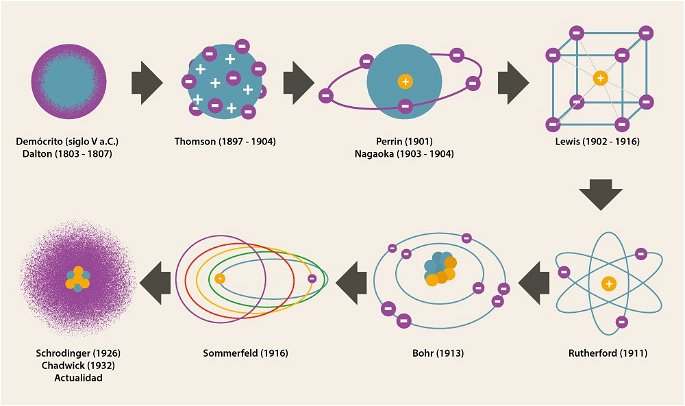
Línea de tiempo de los modelos atómicos, desde Demócrito hasta la actualidad.
| Autor | Año | Descripción del átomo |
|---|---|---|
| Demócrito de Abdera | Siglo V a.C. | Una partícula indivisible, indestructible, incompresible, eterna, invisible y homogénea, que puede variar en tamaño y forma. |
| John Dalton | Entre 1803 y 1807 | Una esfera compacta, sólida, diminuta, indestructible, indivisible y eterna. |
| Joseph John Thomson | Entre 1897 y 1904 | Una esfera compacta e indivisible de carga positiva, con electrones incrustados. |
| Jean Baptiste Perrin | 1901 | Modelo planetario con núcleo atómico, rodeado de electrones como si fueran planetas. |
| Gilbert Newton Lewis | Desarrollado en 1902, publicado en 1916 | Estructura cúbica, con el núcleo atómico en el centro y los electrones posicionados en los ocho vértices. |
| Hantaro Nagaoka | Desarrollado en 1903, publicado en 1904 | Modelo saturnino, con núcleo atómico de carga positiva y electrones dispuestos como los anillos de Saturno. |
| Ernest Rutherford | 1911 | Núcleo atómico muy pequeño y denso formado por protones, y electrones orbitando alrededor en trayectorias distintas. |
| Niels Bohr | 1913 | Los electrones orbitan alrededor del núcleo en niveles energéticos diferentes, según la cantidad de energía que absorben o emiten. |
| Arnold Sommerfeld | 1916 | Los electrones orbitan alrededor del núcleo en diferentes niveles energéticos, describiendo trayectorias circulares o elípticas. |
| Erwin Schrödinger | 1926 | Los electrones se comportan como ondas, posicionados alrededor del núcleo en orbitales. |
| James Chadwick | 1932 | Núcleo del átomo formado por protones y neutrones, rodeados de electrones posicionados en orbitales de diferente energía. |
| Varios autores | Actualidad | Núcleo atómico compuesto de protones y neutrones, rodeado de electrones posicionados en orbitales de energía y formas diferentes. El átomo tiene un comportamiento ondulatorio. |
Ver también: Ejercicios sobre modelos atómicos, Átomo y Orbital atómico
Descripción e historia de los modelos atómicos
1. Modelo atómico de Demócrito (siglo V a.C.)
Demócrito de Abdera fue un filósofo griego quien, bajo el mentoreo de Leucipo, expandió las ideas de la teoría atómica del universo. El filósofo propuso la existencia de una partícula muy pequeña e indivisible, denominado átomo. Llegó a esta conclusión mediante ejercicios de razonamiento lógico, pues la filosofía era una corriente popular en aquellos siglos.
Demócrito atribuyó una serie de características ligadas al átomo. Además de indivisibles, también son indestructibles, incompresibles y eternas, permaneciendo igual a lo largo de los años. También planteó que los átomos son invisibles y homogéneos, sin presentar variaciones a lo largo del átomo.
Asimismo, el filósofo concluyó que no hay nada en el espacio entre átomos, sino que estos penden en el vacío. Por lo tanto, el universo está compuesto por átomos y vacío. A raíz de esto, una sustancia se diferencia de otra dependiendo de la agrupación de átomos y de la forma o tamaño que tengan.
Pasarían más de dos milenos antes de que otra persona propusiera un modelo similar, pero con una mirada más crítica.
2. Modelo atómico de Dalton (entre 1803 y 1807)
El científico británico John Dalton coincidía con la propuesta de Demócrito al decir que los átomos son partículas diminutas, indestructibles e indivisibles. Además, estas nunca cambian con el tiempo y son iguales entre sí cuando hablamos de un mismo elemento.
Para John Dalton, los átomos son esferas compactas y sólidas. Asimismo, un elemento se diferencia de otro por tener partículas de tamaño, masa y propiedades químicas distintas.
Según este científico, los compuestos se forman por átomos de diferentes elementos en proporciones fijas. No obstante, aclaraba que se combinan el menor número posible de átomos de un solo elemento. A raíz de esto, llegó a conclusiones erróneas, como que los gases son monoatómicos o que el agua se formaba con un átomo de hidrógeno y oxígeno (HO, en vez de H2O).
John Dalton también enunció los átomos nunca se crean ni se destruyen, y que las reacciones químicas solo suponen una combinación, separación o reorganización de los mismos.
Te puede interesar Modelo atómico de Dalton.
3. Modelo atómico de Thomson (entre 1897 y 1904)
Joseph John Thomson, otro científico británico, descubrió en 1897 el electrón como parte del átomo gracias a un experimento con rayos catódicos. Observó que los rayos se desviaban, lo que le llevó a concluir que estaban interactuando con una partícula cargada. Al cabo de unos años, elaboró y publicó en 1904 un modelo atómico que fue apodado como Modelo del Pudín de Pasas.
Lo que Thomson propuso es que el átomo es una esfera compacta e indivisible compuesta por dos tipos de partículas. Según él, los electrones, partículas cargadas negativamente, están incrustados dentro de otra partícula más grande. Esta segunda partícula contiene la mayoría de la masa del átomo, y posee una carga positiva distribuida uniformemente.
Thomson recibió el Premio Nobel en 1906 por descubrir el electrón.
Saber más sobre Electrón
4. Modelo atómico de Perrin (1901)
Jean Baptiste Perrin fue un químico y físico francés que matizó el modelo atómico presentado recientemente. Partiendo de la premisa y experimento de Thomson, Perrin demostró que las cargas negativas son externas al núcleo atómico.
Gracias al descubrimiento, Perrin concluyó que el átomo estaba formado por un núcleo de carga positiva, sin electrones incrustados en él. En su lugar, los electrones se encuentran fuera del núcleo, orbitando como planetas alrededor de sol.
Más adelante, Jean Baptiste Perrin recibiría el Premio Nobel de Física en 1926 en su estudio sobre la sedimentación.
5. Modelo atómico de Lewis (desarrollado en 1902, publicado en 1916)
El químico estadounidense Gilbert Newton Lewis propuso un modelo único que no tuvo tanta acogida. Se trata del Modelo del Átomo Cúbico, que consistía en lo siguiente:
- La estructura del átomo tiene forma de cubo.
- El núcleo del átomo se encuentra en el centro del cubo.
- Los electrones se disponen alrededor del núcleo, posicionándose en uno de los ocho vértices del cubo.
Llegó a esta propuesta sirviéndose de la regla de Abegg, que establece que la diferencia entre el número máximo y mínimo de oxidación suele ser ocho.
Aunque el modelo fue desestimado poco después, fue útil para introducir el concepto de valencia y su importancia en los enlaces químicos. La valencia consiste en electrones situados en el último nivel de energía, capaces de reaccionar o enlazarse con otros elementos.
Seguido de esto, Lewis introdujo la estructura de Lewis, el concepto del par de electrones en los enlaces covalentes y la regla del octeto.
6. Modelo atómico de Nagaoka (desarrollado en 1903, publicado en 1904)
Hantaro Nagaoka fue un físico japonés que rechazó el modelo propuesto por Thomson. La razón que dio es que una carga no puede contener a otra, afirmando que las cargas eléctricas son impenetrables. Por lo tanto, los electrones no podían estar incrustados en el núcleo del átomo de carga positiva.
En su lugar, Nagaoka propuso un átomo con una distribución similar a Saturno y sus anillos. Saturno representa la carga positiva del átomo, mientras que los anillos son los electrones que orbitan alrededor, separados del núcleo. Este modelo fue apodado como Modelo Saturnino.
Nagaoka explicó que los electrones giraban alrededor, atados por fuerzas electrostáticas. Sin embargo, no tomó en cuenta el hecho de que los electrones se repelen cuando están cerca entre ellos, por lo que este modelo se desestimó.
7. Modelo atómico de Rutherford (1911)
Ernest Rutherford fue un físico neozelandés que contribuyó mucho en el estudio de la radiación. En uno de sus experimentos, envió partículas alfa a gran velocidad contra una lámina de oro. El físico se percató que algunas partículas se desviaban e incluso rebotaban, describiendo una trayectoria de 90º o más.
Para que dicho fenómeno sucediese, Rutherford dedujo que el núcleo atómico debía ser muy pequeño y denso. Asimismo, debía contener un tipo de partícula cargada positivamente, el electrón positivo o protón.
Alrededor del núcleo atómico orbitan los electrones. A diferencia de Nagaoka, Rutherford dijo que los electrones describen trayectorias aleatorias. Entre ellos y los protones hay un espacio vacío.
Con este modelo, Rutherford afirmaba dos cosas. Por un lado, la masa del átomo es aproximadamente igual a la masa de los electrones y protones. Por el otro, los átomos estables tienen el mismo número de electrones y protones.
Ernest Rutherford recibió el Premio Nobel de Química en 1908 por sus estudios y descubrimientos sobre las partículas radiactivas.
Saber más sobre Protón
8. Modelo atómico de Bohr (1913)
Niels Bohr fue un físico danés que elaboró un modelo atómico basado en las teorías de Rutherford. Durante un experimento, Bohr vio que la radiación emitida por los átomos excitados de un gas describía espectros de radiación discontinuos.
Al observar los distintos espectros, Bohr entendió que los electrones se mueven en órbitas con distintos niveles de energía. Es a partir de esta idea que surgen las capas o niveles energéticos, siendo los electrones más alejados del núcleo los que presentan mayor energía.
Profundizó en esta idea explicando que un electrón puede subir a un nivel energético mayor al absorber fotones. Asimismo, si un electrón emite un fotón, pierde energía y baja a un nivel energético menor. Con esto, Bohr explicaba los espectros de emisión y absorción de radiación.
Este modelo propuesto por Niels Bohr fue un gran avance científico, sentando parte de las bases de la mecánica cuántica actual. El problema con este modelo es que no sirvió para explicar la estructura de otros átomos que no fueran el hidrógeno, el cual contiene un solo electrón.
Niels Bohr recibió el Premio Nobel de Física en 1922 por sus trabajos sobre la radiación y la estructura atómica.
9. Modelo atómico de Sommerfeld (1916)
Arnold Sommerfeld, un físico alemán, afinó el modelo de Bohr para representar átomos con más de un electrón. Apoyándose en la teoría de la relatividad de Albert Einstein, Sommerfeld propuso un modelo atómico relativista.
Según él, las órbitas de los electrones podían ser circulares o elípticas. Además, expandió en la idea de los niveles energéticos, afirmando que también existen los subniveles. Es decir, dos electrones podían estar en un mismo nivel energético, pero distinto subnivel. Con esto, Sommerfeld se aproximaba al concepto de las nubes electrónicas, sin entrar en ello.
Su propuesta sobre los subniveles energéticos y las trayectorias elípticas o circulares era apto para átomos con varios electrones. No obstante, Sommerfeld obviaba la interacción entre los electrones.
10. Modelo atómico de Schrödinger (1926)
Erwin Schrödinger fue un físico y filósofo austríaco que elaboró un modelo atómico basado en el comportamiento onda-partícula, propuesto por Louis de Broglie.
Según Schrödinger, los electrones son ondulaciones u ondas de la materia. A efectos prácticos, lo que sugirió es que no podemos definir la posición exacta de un electrón, sino las posibles regiones en las que puede residir. Por lo tanto, este modelo proponía un átomo con un núcleo atómico central, rodeado de electrones dispuestos alrededor en regiones diferentes, llamados orbitales.
Erwin Schrödinger recibió el Premio Nobel de Física en 1933 por desarrollar la ecuación de Schrödinger.
11. Modelo atómico de Chadwick (1932)
James Chadwick, un físico inglés, elaboró un experimento en el que bombardeó una lámina delgada de berilio con partículas alfa. En dicho experimento, Chadwick se dio cuenta que se emitía un tipo de partículas sin carga eléctrica, que luego bautizaría como neutrón.
Gracias a este descubrimiento, James Chadwick propuso un modelo atómico que consistía en lo siguiente:
- El átomo está formado por un núcleo central compuesto por protones y neutrones.
- La mayor parte de la masa del átomo se encuentra en el mismo núcleo.
- Los electrones, con una masa muchísimo menor, se mueven alrededor del núcleo en orbitales.
Recibió el Premio Nobel de Física en 1935 por el descubrimiento del neutrón.
Modelo actual
El modelo actual es el modelo atómico cuántico. Este modelo establece que el átomo y sus partes tienen un comportamiento ondulatorio. A grandes rasgos, los electrones residen alrededor del núcleo en orbitales o nubes electrónicas de formas distintas, sin posición exacta definida y con niveles de energía diferentes.
También le puede interesar:
Referencias
Bohr, Niels (1913). "On the constitution of atoms and molecules". Philosophical Magazine. 26 (153): 476–502.
Lewis, Gilbert N. (April 1916). "The atom and the molecule". Journal of the American Chemical Society. 38 (4): 762–785. doi:10.1021/ja02261a002. S2CID 95865413.
Rocke, Alan J. (2005). "In Search of El Dorado: John Dalton and the Origins of the Atomic Theory". Social Research. 72 (1): 125–158. doi:10.1353/sor.2005.0003. JSTOR 40972005. S2CID 141350239.
Rutherford, E. (1911). "The scattering of α and β particles by matter and the structure of the atom". The London, Edinburgh, and Dublin Philosophical Magazine and Journal of Science. Series 6. 21 (125): 669–688.
Thomson, J. J. (1904). "On the Structure of the Atom: an Investigation of the Stability and Periods of Oscillation of a number of Corpuscles arranged at equal intervals around the Circumference of a Circle; with Application of the Results to the Theory of Atomic Structure". Philosophical Magazine. 7 (39): 237. doi:10.1080/14786440409463107.
van Melsen, Andrew G. & Koren, H. J. (1958). "From Atomos to Atom : The History of the Concept Atom", Philosophical Series, I. Revue Philosophique de la France Et de l'Etranger 148:103-104.
Cómo citar: Rhoton, Stephen (26/10/2023). "Modelos atómicos". En: Significados.com. Disponible en: https://www.significados.com/modelos-atomicos/ Consultado: