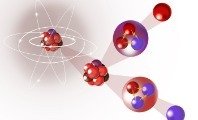
Átomo
El átomo es la partícula más simple que forma la materia y diferencia una sustancia de otra según su composición. En la actualidad, se conoce que el átomo está formado por electrones, protones y neutrones. A su vez, estos están compuestos por partículas subatómicas más pequeñas, los cuarks.
Los átomos de una misma clase forman los elementos de la tabla periódica. Así, los átomos del hidrógeno se caracterizan por tener un electrón y un protón, mientras el átomo de oxígeno posee 8 electrones, 8 protones y 8 neutrones.
Los átomos pueden unirse para formar moléculas. Por ejemplo, el agua está formada por átomos de hidrógeno y oxígeno que se combinan para formar la molécula de agua H₂O, esto es, dos átomos de hidrógeno por un átomo de oxígeno.
Si esta combinación cambia, estamos en presencia de otra sustancia. Un caso es el agua oxigenada (H₂O₂), que está formada por dos átomos de hidrógeno y dos átomos de oxígeno.
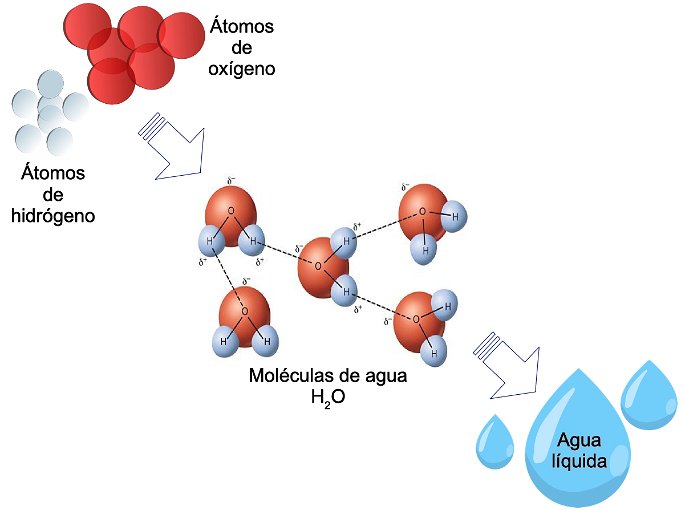
Un átomo de oxígeno y dos átomos de hidrógeno se juntan para formar una molécula de agua.
La primera noción del átomo surgió en la antigua Grecia (siglo V a. de C.) con Leucipo y Demócrito. La palabra "átomo" aparece en esta época, para indicar algo que era imposible de dividir.
La idea del átomo vuelve a surgir hasta principio del siglo XIX, gracias al meteorólogo inglés John Dalton. En los dos últimos siglos, los avances tecnológicos han permitido profundizar en el conocimiento del átomo. Hoy en día, conocemos la estructura y componentes del átomo.
Saber más sobre Modelo atómico de Dalton y Niveles de organización de la materia.
Estructura y partes del átomo
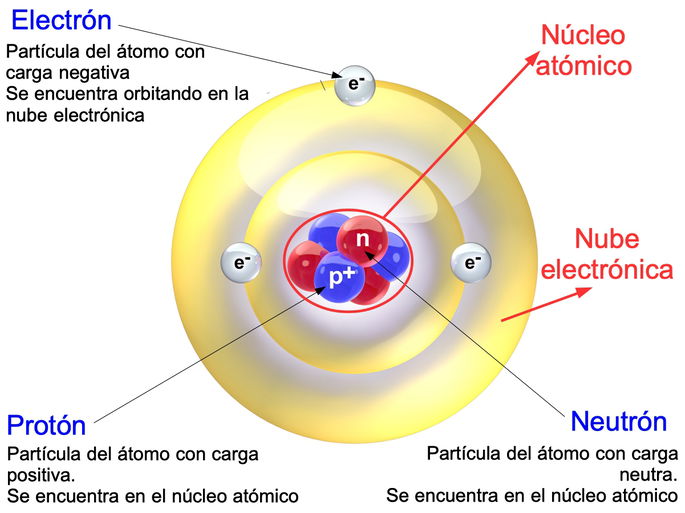
La estructura atómica se compone de las siguientes partes:
- Núcleo: es la región que concentra los protones y neutrones en el centro del átomo. Tiene carga positiva dada por los protones y representa el 99,9 % de la masa total del átomo. Sin embargo, en cuanto a espacio físico, el núcleo ocupa una ínfima parte del átomo.
- Nube electrónica: es la región externa del átomo donde se encuentran los electrones. Ocupa la mayor parte del átomo y presenta orbitales en los que se reparten los electrones en diferentes niveles energéticos.
Veamos en profundidad qué son los neutrones, protones y electrones.
Ver también:
Neutrones
El neutrón es la partícula sin carga eléctrica que se encuentra en el núcleo atómico. El número de neutrones cambia entre los isótopos de un mismo átomo, es decir, átomos con el mismo número de protones pero diferente número de neutrones.
Por ejemplo, el nitrógeno (N) tiene 7 protones en su núcleo, pero puede tener dos isótopos: uno con 7 neutrones y otro con 8 neutrones.
El neutrón fue descubierto en 1932 por James Chadwick. Una cosa a tener en cuenta es que todos los elementos poseen neutrones, a excepción del nitrógeno.
Protones
El protón es una partícula con carga eléctrica positiva, de valor +1, que se encuentra en el núcleo. La cantidad de protones de un átomo determina el número atómico Z, el número con el que se ordena en la tabla periódica.
Por ejemplo, el hidrógeno tiene solo un protón, así que su número atómico es 1. En cambio, el oxígeno tiene 8 protones, por lo que su número atómico es 8.
El protón fue descubierto en 1919 por Ernest Rutherford.
Electrones
El electrón es una partícula con carga negativa, de valor -1, que orbita alrededor del núcleo atómico. Los electrones determinan la reactividad química entre los átomos y sus propiedades electromagnéticas.
J.J. Thomson descubrió el electrón en 1897 mediante un experimento con rayos catódicos.
Vea también Protón, Neutrón, Electrón y Configuración electrónica.
Características del átomo
- La mayoría de la masa atómica está concentrada en los protones y neutrones. De hecho, la masa de los electrones se considera despreciable al calcular la masa total de un átomo.
- Los electrones son las partículas que permiten a un átomo enlazarse con otro.
- Los electrones pueden saltar al siguiente nivel energético cuando absorben fotones. Asimismo, al emitir un fotón, el electrón baja de nivel energético.
- Los átomos pueden tener carga positiva o negativa dependiendo de si ha perdido o ganado electrones mediante reacciones químicas.
- El número atómico Z es la cantidad de protones que tiene un átomo, y es el número que ayuda a diferenciar un elemento de otro en la tabla periódica.
- El número másico A indica la cantidad de nucleones (protones y neutrones) que hay en un átomo. Este número ayuda a diferenciar un isótopo de otro, pues poseen diferentes cantidades de neutrones.
- Los átomos se pueden agrupar para formar moléculas de uno, dos o más elementos.
- Los protones y neutrones se mantienen unidos gracias a la fuerza nuclear fuerte, la más fuerte de las cuatro fuerzas fundamentales de la física.
Historia del átomo
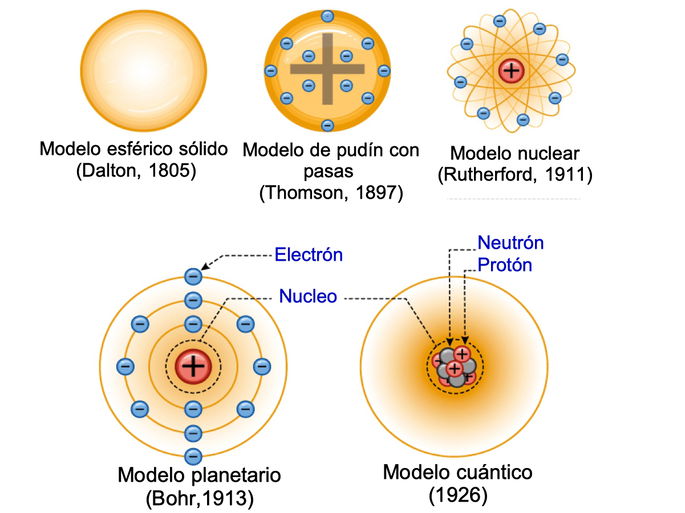
El átomo se ha representado con diferentes modelos atómicos a lo largo de los años.
Los filósofos griegos Leucipo y Demócrito plantearon en el siglo V a. de C. que los materiales podrían dividirse en porciones más pequeñas, hasta un punto donde ya no sería posible seguir dividiéndose. Ese sería el átomo, que en griego significa "indivisible".
La primera teoría atómica fue propuesta por John Dalton entre 1803 y 1807. En su teoría, Dalton presentaba los átomos como simples partículas, que al unirse, formaban los materiales que vemos y conocemos.
Cuando se descubrió el electrón al final del siglo XIX, J.J. Thomson propuso un modelo donde el átomo era representado por una masa con carga positiva con electrones incrustados. A este modelo se le conoció como el modelo de pudín con pasas.
En 1911, Rutherford estableció un nuevo modelo atómico parecido al sistema solar. En él, el átomo estaba representado por un núcleo central que era rodeado por los electrones.
En 1913, Niels Bohr critica el modelo atómico de Rutherford, y crea el modelo atómico planetario. En este, los electrones giran en órbitas predeterminadas alrededor del núcleo central, como los planetas orbitan el Sol.
Apenas en 1919 se descubrió el protón y una década después el neutrón. Luego, con la construcción de los aceleradores de partículas, se han detectado otras partículas subatómicas, como los quarks.
El modelo atómico cuántico más reciente establece que el átomo está estructurado como un núcleo central donde protones y neutrones se agrupan. A su vez, los electrones se encuentran en una nube de probabilidades alrededor del núcleo.
La primera foto de átomos pesados, el uranio y el torio, fue tomada en 1970 usando un microscopio electrónico de alta resolución.
Vea también:
Referencias
Crewe, A.V., Wall, J., Langmore, J. (1970) Visibility of single atoms. Science 168: 1338-1340
Rosenberg, J.L., Epstein, L.M., Krieger, P.J. (2007). Schaum's outline of Theory and Problems of College Chemistry. 9th ed. McGraw-Hill. NY
Sundaresan, M.K. (2001) Handbook of particle physics. CRC Press, Washington, D.C.
Cómo citar: (27/11/2023). "Átomo". En: Significados.com. Disponible en: https://www.significados.com/atomo/ Consultado: