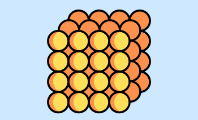
Modelo atómico de Dalton
El modelo atómico de John Dalton fue el primero que se publicó con alguna base científica. Publicó su teoría entre 1803 y 1807, presentando los átomos como partículas simples que se unen para formar los materiales que vemos y conocemos.
Su modelo atómico se conoce a veces como "bola de billar", pues algunas de las características descritas en su modelo se asemejan al objeto. El motivo es que Dalton afirmaba que el átomo es una esfera maciza y compacta, similar a una bola de billar.
Antes de John Dalton, varios filósofos y científicos propusieron algunas ideas sobre las características de los átomos y elementos. Algunos de ellos fueron Demócrito, Leucipo, William Higgins, Antoine Lavoisier y Joseph Louis Proust. De hecho, John Dalton aprovechó diversos estudios y teorías elaboradas por estas personas para establecer su teoría atómica y los correspondientes postulados.
John Dalton compartió una serie de postulados tras estudiar diferentes elementos. Por ejemplo, concluyó que dos elementos se diferencian por tener átomos con diferente masa y tamaño, o que los compuestos se forman por átomos de diferentes elementos que se reorganizan.
A raíz de su estudio sobre los átomos, Dalton elaboró una tabla de pesos atómicos relativos al hidrógeno. Incluía elementos clave como el oxígeno, nitrógeno, carbono, azufre y fósforo, además de otros como el cobre, estaño, magnesio, sodio, potasio, zinc, plata u oro.
Esta tabla sirvió para tener una idea aproximada de las masas atómicas de cada elemento. Sin embargo, Dalton sacó conclusiones erróneas, pues no sabía que en la naturaleza algunos elementos se encuentran en estado molecular, como el oxígeno (O2).
Características del átomo según el modelo de Dalton
John Dalton describió el átomo con una serie de características distintivas. Aquí las enumeramos.

El átomo es la partícula más pequeña que compone toda la materia. Según Dalton, el componente más pequeño hallado en todo elemento, objeto y ser vivo es el átomo. El conjunto de ellos es lo que da forma a todo lo que nos rodea.
Es indivisible. Dalton concluyó que el átomo era la partícula más pequeña y añadió que el átomo no se podía dividir. Por tanto, el átomo se trataba de una partícula completa por sí misma, que no se puede partir o separar en otras partículas más pequeñas.
Es una esfera maciza y sólida. Para él, el átomo era un objeto compacto y perfectamente esférico, razón por la que a veces se atribuye a este modelo el nombre de "bola de billar".
Es indestructible e impenetrable. Dalton definió el átomo como una partícula que no se podía romper, atravesar o dañar de alguna forma, sin importar el método que se emplease. Como mucho, los átomos pueden ser desplazados de un punto del espacio a otro.
Es eterno y nunca cambia. Para terminar, Dalton estableció que el átomo permanece igual en todo momento, desde que se originó el universo. En otras palabras, él niega la posibilidad de que el átomo pueda alterarse de alguna forma, por lo que siempre será un átomo con las mismas características y del elemento al que pertenece.
Postulados del modelo atómico de Dalton
Las ideas que compartió Dalton al elaborar su modelo atómico se pueden resumir en los siguientes postulados:
- Toda la materia está formada por átomos, unas partículas muy pequeñas, esféricas, macizas, indivisibles e indestructibles. Se trata entonces de esas partículas que dan forma a todos los seres vivos y objetos.
- Los átomos de un mismo elemento presentan las mismas propiedades, como la masa o el tamaño. Dalton desarrolló esta idea indicando que los átomos de elementos diferentes tienen masas distintas. Asimismo, declaró el peso atómico como la masa del átomo de un elemento relativo a la masa del átomo de hidrógeno.
- Toda reacción química sucede por una reorganización de átomos. Dalton negaba la posibilidad de que los átomos se creasen, se destruyesen o cambiasen su naturaleza durante una reacción química. Por tanto, la masa total se mantiene igual antes y después de cualquier reacción.
- Los compuestos son combinaciones de átomos de diferentes elementos. Según él, los compuestos se forman cuando los átomos de diversos elementos cambian de posición y se juntan de diferentes formas, dando lugar a las sustancias que conocemos.
- Al formarse compuestos, los átomos guardan relaciones numéricas simples entre sí. Otra idea que compartía Dalton era que la unión de átomos de diferentes elementos sucedía en la menor proporción posible. Es decir, afirmaba que el agua se formaba por un átomo de hidrógeno con otro átomo de oxígeno (HO).
Estos postulados surgieron a partir de ideas que otros científicos desarrollaron. Por un lado, tenemos la Ley de conservación de la masa, formulada por Antoine Lavoisier. Esta ley declara que la masa se conserva durante todas las reacciones químicas, lo que le sirvió a Dalton para afirmar que una reacción química es solo una reorganización de átomos.
Por el otro lado, la Ley de las proporciones definidas, postulada por Joseph Louis Proust, afirma que la proporción de elementos que forman un compuesto es constante. Dalton tomó dicha idea y fue más allá, indicando que dicha proporción es la más simple posible, usualmente de 1:1.
Errores en el modelo atómico de Dalton
Debido al desconocimiento de la estructura interna de los átomos, Dalton no tuvo en cuenta la existencia de los electrones, protones y neutrones, además de cuarks, muones, fotones y otras partículas. Por tanto, afirmar que el átomo es una esfera maciza e indivisible es incorrecto, pues el átomo se compone a su vez de partículas subatómicas.
Dalton aseguraba que los átomos de un elemento siempre eran iguales. Actualmente, sabemos que no es cierto debido a la existencia de los isótopos. Dependiendo del isótopo, la masa del átomo varía por la diferente cantidad de neutrones. Tampoco tuvo en cuenta los iones, en el que la masa y composición del átomo varía ligeramente al aceptar o ceder electrones.
En el momento de determinar las masas atómicas de un elemento, Dalton no sabía que algunos elementos se encuentran en estado molecular en la naturaleza. Un ejemplo es el oxígeno puro, que consta de dos átomos de oxígenos unidos para formar O2. Cuando estudió su masa, atribuyó la masa del oxígeno molecular como si fuera solo un átomo de oxígeno.
Sumado a lo anterior, él erró al considerar que átomos de diferentes elementos se juntan en la menor proporción posible. El hidrógeno y oxígeno, por ejemplo, pueden unirse como H2O para formar agua u H2O2 para formar agua oxigenada. Otro ejemplo es el hierro reaccionando con oxígeno, que pueden formar óxido de hierro(II), FeO, u óxido de hierro(III), Fe2O3.
Por último, Dalton aseguró que los átomos son eternos y que nunca cambian. Sabemos que esto no es verdad por los fenómenos de la fusión y fisión nuclear, en que los átomos cambian de elemento al interactuar con otros. Asimismo, la ionización y la formación de isótopos cambia la composición de los átomos.
Vea también:
Referencias
Rocke, Alan J. (2005). "In Search of El Dorado: John Dalton and the Origins of the Atomic Theory". Social Research. 72 (1): 125–158. doi:10.1353/sor.2005.0003. JSTOR 40972005. S2CID 141350239.
van Melsen, Andrew G. & Koren, H. J. (1958). "From Atomos to Atom: The History of the Concept Atom", Philosophical Series, I. Revue Philosophique de la France Et de l'Etranger 148:103-104.
Cómo citar: Rhoton, Stephen (21/05/2025). "Modelo atómico de Dalton". En: Significados.com. Disponible en: https://www.significados.com/modelo-atomico-de-dalton/ Consultado: