Nomenclatura química
Se llama nomenclatura química a un sistema de reglas que permite dar nombre a los diferentes compuestos químicos según el tipo y número de elementos que los componen. La nomenclatura ayuda a identificar, clasificar y organizar los compuestos químicos.
El propósito de la nomenclatura química es asignar a las sustancias químicas nombres, sufijos y prefijos, llamados también descriptores. Este procedimiento hace que las sustancias sean fácilmente reconocibles y se pueda consolidar una convención.
Dentro de la nomenclatura química, se distinguen dos grandes grupos de compuestos:
- Compuestos orgánicos, referidos a aquellos con presencia de carbono enlazado con moléculas de hidrógeno, oxígeno, azufre, nitrógeno, boro y ciertos halógenos;
- Compuestos inorgánicos, que se refieren a todo el universo de compuestos químicos que no incluyen moléculas de carbono.
La principal institución encargada de regular o establecer las convenciones es la Unión Internacional de Química Pura y Aplicada o IUPAC por sus siglas en inglés (International Union of Pure and Applied Chemistry). Por esa razón, a la nomenclatura química también se le llama nomenclatura IUPAC.
Tipos de nomenclatura química
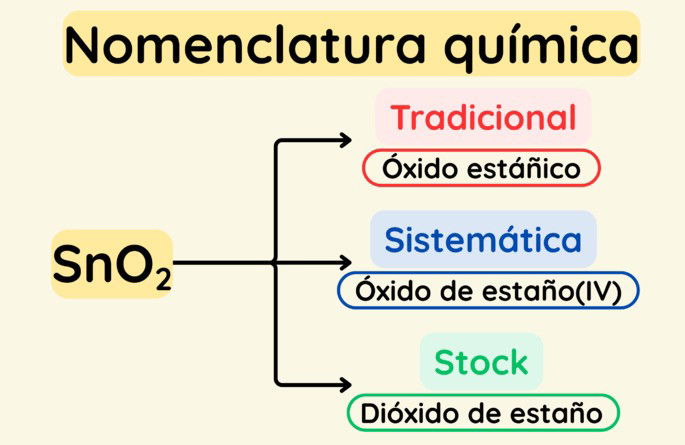
Existen tres sistemas de nomenclatura química:
- Sistema de nomenclatura tradicional, funcional o clásico;
- Sistema de nomenclatura sistemática o estequiométrica; y
- Sistema de nomenclatura Stock.
Dependiendo del sistema de nomenclatura utilizado, un mismo compuesto puede recibir diferentes nombres. Por ejemplo, SnO2 puede llamarse óxido estáñico (nomenclatura tradicional), óxido de estaño(IV) (nomenclatura de Stock) o dióxido de estaño (nomenclatura estequiométrica).
Sistema de nomenclatura tradicional, funcional o clásico
Las sustancias químicas se clasifican de acuerdo a las diferentes valencias que posean. Estas se representan verbalmente con el uso de prefijos y sufijos.
Vea unos ejemplos en la siguiente tabla:
| N.º valencia | Prefijos y sufijos | Ejemplos |
|---|---|---|
| 1 | Se usa el conector "de" o el sufijo -ico | K2O, óxido de potasio u óxido potásico |
| 2 |
-oso (valencia menor) -ico (valencia mayor) |
FeO, óxido ferroso Fe2O3, óxido férrico |
| 3 |
hipo + nombre + oso (valencia menor) -oso (valencia intermedia) -ico (valencia mayor) |
SO, óxido hiposulfuroso SO2, óxido sulfuroso SO3, óxido sulfúrico |
| 4 |
hipo + nombre + oso (valencia más pequeña) -oso (valencia pequeña) -ico (valencia intermedia) per + nombre + ico (valencia grande) |
Cl2O, óxido hipocloroso Cl2O3, óxido cloroso Cl2O5, óxido clórico Cl2O7, óxido perclórico |
Sistema de nomenclatura sistemática o estequiométrica
Este es el más extendido en la actualidad y es reconocido por la IUPAC. Nombra las sustancias con prefijos numéricos griegos que indican la atomicidad (número de átomos) presente en las moléculas. La fórmula para nombrar los compuestos puede resumirse de la siguiente manera: prefijo-nombre genérico + prefijo-nombre específico.
Veamos la siguiente tabla para orientarnos:
| N.º átomos de C | Prefijo | Ejemplos |
|---|---|---|
| 1 | met- o mono- |
CH4, metano CO, monóxido de carbono |
| 2 | et- o di- |
CO2, dióxido de carbono C2H6, etano |
| 3 | prop- o tri- |
C3H8, propano CrBr3, tribromuro de cromo |
| 4 | but- o tetra- |
C4H10, butano Cl4C, tetracloruro de carbono |
| 5 | penta- |
C5H12, pentano N2O5, pentóxido de dinitrógeno |
| 6 | hexa- | C6H14, hexano |
| 7 | hepta- |
C7H16, heptano Cl2O7, heptóxido de dicloro |
| 8 | octa- | C8H18, octano |
| 9 | non-, nona- o eneá- | C9H20, nonano |
| 10 | deca- | C10H22, decano |
Sistema de nomenclatura Stock
En la actualidad, la IUPAC está promoviendo la estandarización de este método en lugar de los que usan sufijos, debido a que los estos resultan difíciles en algunas lenguas. El sistema elegido es el llamado Stock, que recibe su nombre de su creador, el químico alemán Alfred Stock (1876-1946).
El sistema Stock agrega al final del elemento números romanos que indican la valencia de los átomos. Es decir, los números romanos indican el estado de oxidación de alguno de los elementos que puedan estar presentes en la sustancia química. Se deben disponer al final del nombre de la sustancia y entre paréntesis.
Por ejemplo:
| N.º valencias | Nomenclatura |
|---|---|
| 2 | H2S, Sulfuro(II) de hidrógeno |
| 2 | MgBr2, Bromuro de magnesio(II) |
| 2 | FeO, óxido de hierro(II) |
| 3 | Fe2O3, óxido de hierro(III) |
| 3 | N2O3, óxido de nitrógeno(III) |
| 3 | P2O3, óxido de fósforo(III) |
| 4 | SO2, óxido de azufre(IV) |
| 4 | SeO2, óxido de selenio(IV) |
| 5 | Cl2O5, óxido de cloro(V) |
| 5 | N2O5, óxido de nitrógeno(V) |
Vea también Oxidación.
Otras reglas a tener en cuenta en la nomenclatura química
Dependiendo de los compuestos que queremos nombrar, se siguen algunas reglas específicas.
Hidróxidos
Los hidróxidos o bases, que contienen una combinación de oxígeno e hidrógeno (OH), se identifican como hidróxido. Por ejemplo, KOH se conoce como hidróxido de potasio.
Óxidos no metálicos
En el caso de óxidos no metálicos, óxidos ácidos o anhídridos, la nomenclatura tradicional sigue la misma pauta que con otros compuestos, pero se utiliza el término anhídrido en vez de óxido. Por ejemplo, el CO2 se conoce como anhídrido carbónico.
Ácidos
Los ácidos compuestos de oxígeno, un no metal e hidrógeno siguen diferentes pautas acordes a la nomenclatura:
- Nomenclatura tradicional: se utiliza el término ácido para identificar la presencia de oxígeno e hidrógeno. Por ejemplo, H2CO3 es ácido carbónico.
- Nomenclatura sistemática: se añade el prefijo oxo- y el sufijo -ato al no metal. Por ejemplo, H2CO3 es trioxocarbonato de dihidrógeno.
- Nomenclatura Stock: se añade el sufijo -ato al no metal, y luego se escribe de hidrógeno. Por ejemplo, H2CO3 es carbonato(IV) de hidrógeno.
Hidrácidos
Los hidrácidos, es decir, aquellos ácidos que contienen hidrógeno (pero no oxígeno) siguen las siguientes pautas:
- Nomenclatura tradicional y sistemática: se añade el término ácido y luego se nombra el no metal con el sufijo -hídrico. Por ejemplo, HF es ácido fluorhídrico.
- Nomenclatura Stock: se añade el sufijo -uro al no metal, y luego se escribe de hidrógeno. Por ejemplo, HF es fluoruro de hidrógeno.
Vea también Óxidos, Ácidos y bases.
Ejemplos de nomenclatura química para practicar
Ejercicio 1
Nombra el siguiente compuesto usando los tres tipos de nomenclatura: Fe2O3. Recuerda: Fe es hierro, mientras que O es oxígeno.
Ejercicio 2
Nombra el siguiente compuesto usando los tres tipos de nomenclatura: Cl2O7. Recuerda: Cl es cloro, mientras que O es oxígeno.
Ejercicio 3
Nombra el siguiente compuesto usando los tres tipos de nomenclatura: H2SO4. Recuerda: H es hidrógeno, S es azufre y O es oxígeno.
Ejercicio 4
Nombra el siguiente compuesto usando los tres tipos de nomenclatura: MnCl2. Recuerda: Mn es manganeso y Cl es cloro.
Vea también:
Cómo citar: Rhoton, Stephen (29/04/2025). "Nomenclatura química". En: Significados.com. Disponible en: https://www.significados.com/nomenclatura-quimica/ Consultado: