Electrones de valencia
Los electrones de valencia son electrones que se ubican en la última capa energética o nivel energético de un átomo, llamada también capa de valencia. Recuerda que los electrones son las partículas del átomo que presentan carga negativa.
Los átomos se sirven de los electrones de valencia para formar enlaces químicos con otros átomos. Por ejemplo, en un enlace covalente, dos o más átomos se enlazan compartiendo algunos de sus electrones de valencia. En un enlace iónico, uno de los átomos cede electrones de valencia, mientras que el otro los acepta.
Por tanto, los átomos contienen dos tipos de electrones: los de valencia, ubicados en la capa más externa, y los internos, situados en niveles energéticos inferiores. Cabe mencionar que no todos los electrones de valencia tienen por qué participar en la formación de enlaces.
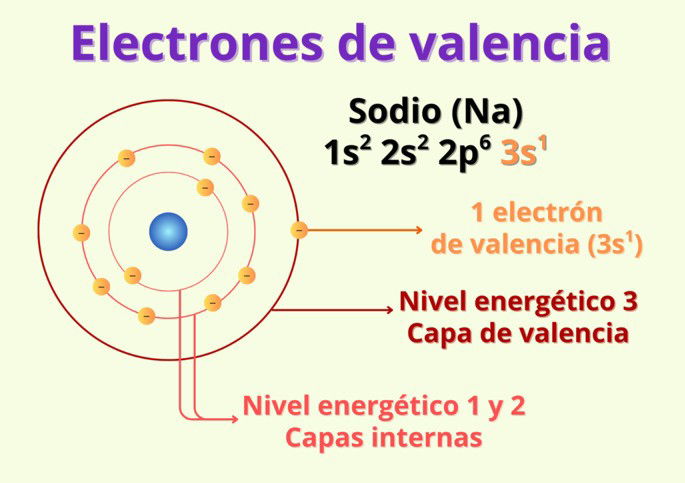
Veamos un ejemplo con el sodio (Na). Un átomo de este elemento contiene 11 electrones, repartidos en diferentes capas según la siguiente configuración electrónica: 1s2 2s2 2p6 3s1.
Lo que nos dice la configuración electrónica es que posee 2 electrones en el primer nivel energético (1s2), 8 electrones en el segundo nivel energético (2s2 2p6), y 1 electrón en el tercer y último nivel energético (3s1). Como el sodio solo posee un electrón en el último nivel energético, eso significa que solo tiene 1 electrón de valencia.
Los electrones de valencia también son claves para que los átomos alcancen la estabilidad de los gases nobles, los cuales poseen 2 (en el caso del helio) u 8 electrones de valencia. Los otros elementos comparten, ceden o aceptan electrones de valencia para lograr este fin.
A su vez, la cantidad de electrones de valencia que posee un átomo nos da una pista de la electronegatividad del elemento. Si un elemento presenta varios electrones de valencia, como el cloro (7 electrones), tenderá más a aceptar un electrón para tener 8, como un gas noble. Es decir, es un elemento muy electronegativo.
Ejemplos de electrones de valencia en diferentes elementos
Echemos un vistazo a los siguientes ejemplos para descubrir cuántos electrones de valencia tiene algunos de los elementos. Comentamos también unos casos particulares en que un átomo puede tener varios electrones de valencia o superar los 8 electrones de valencia de los gases nobles.
Hidrógeno
La configuración electrónica del hidrógeno es de 1s1. Como solo tiene 1 electrón, esto implica que ese único electrón es también el electrón de valencia. Por tanto, el hidrógeno comparte su electrón con otro átomo para alcanzar la configuración electrónica del helio, de 2 electrones.
Carbono
La configuración electrónica del carbono es 1s2 2s2 2p2. Como podemos ver, el carbono contiene dos niveles energéticos (1 y 2). En el segundo nivel presenta dos electrones por cada subnivel (s y p); si los sumamos, veremos que el carbono posee 4 electrones de valencia.
Cloro
La configuración electrónica del cloro es 1s2 2s2 2p6 3s2 3p5. Posee tres niveles energéticos, en el que el último se reparte entre los subniveles s (3s2) y p (3p5). Al sumar ambas cantidades, anotamos que el cloro posee 7 electrones de valencia.
Calcio
La configuración electrónica del calcio es 1s2 2s2 2p6 3s2 3p6 4s2. Estamos ante un elemento cuyo átomo contiene cuatro niveles energéticos. Como el nivel más alto, el cuarto, solo presenta un subnivel con dos electrones, eso significa que el calcio tiene 2 electrones de valencia.
Caso particular 1: hierro
De forma estricta, la configuración electrónica del hierro es 1s2 2s2 2p6 3s2 3p6 4s2 3d6. Igual que el calcio, el hierro tiene cuatro niveles energéticos, pero tiene una particularidad: los subniveles 4s y 3d están muy cerca en términos de nivel de energía.
Por esta razón, en vez de 2 electrones de valencia, el hierro puede tener hasta 8 electrones de valencia. Una prueba de ello es que el hierro es capaz de alcanzar un estado de oxidación de +2, +3 e incluso mayor. Por tanto, no solo cede electrones del subnivel 4s (solo 2 electrones en total), sino también del subnivel 3d.
El caso del hierro es similar a la mayoría de los metales, así como los metales de transición y de transición interna.
Caso particular 2: paladio
La configuración electrónica del paladio es 1s2 2s2 2p6 3s2 3p6 3d10 4s2 4p6 4d10. Como el cuarto nivel tiene 18 electrones repartidos en los subniveles 4s, 4p y 4d, todos ellos son electrones de valencia, ¿verdad?
No es así, pues el subnivel 4d presenta bastante más energía respecto a los subniveles 4s y 4p. Por tanto, el paladio tiene 10 electrones de valencia.
Vea también Configuración electrónica y Electrón.
Tabla periódica con electrones de valencia
Aquí mostramos la tabla periódica con los electrones de valencia para todos los elementos conocidos:
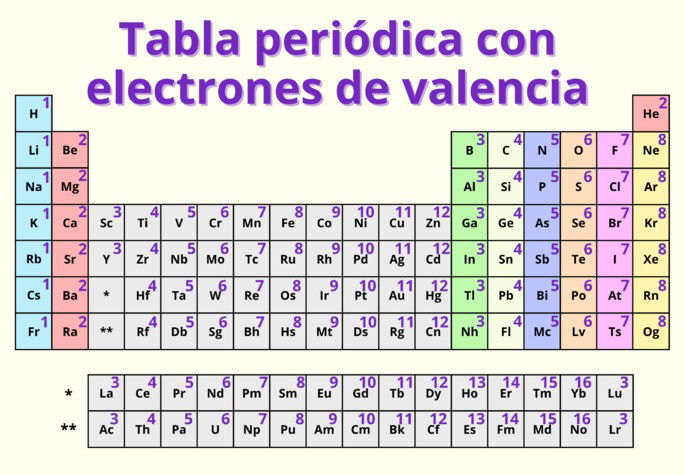
A continuación, compartimos una tabla con los elementos ordenados según su número atómico y los electrones de valencia que presentan. Enmarcamos en negrita los gases nobles.
| Número atómico | Elemento | Electrones de valencia |
|---|---|---|
| 1 | Hidrógeno | 1 |
| 2 | Helio | 2 |
| 3 | Litio | 1 |
| 4 | Berilio | 2 |
| 5 | Boro | 3 |
| 6 | Carbono | 4 |
| 7 | Nitrógeno | 5 |
| 8 | Oxígeno | 6 |
| 9 | Flúor | 7 |
| 10 | Neón | 8 |
| 11 | Sodio | 1 |
| 12 | Magnesio | 2 |
| 13 | Aluminio | 3 |
| 14 | Silicio | 4 |
| 15 | Fósforo | 5 |
| 16 | Azufre | 6 |
| 17 | Cloro | 7 |
| 18 | Argón | 8 |
| 19 | Potasio | 1 |
| 20 | Calcio | 2 |
| 21 | Escandio | 3 |
| 22 | Titanio | 4 |
| 23 | Vanadio | 5 |
| 24 | Cromo | 6 |
| 25 | Manganeso | 7 |
| 26 | Hierro | 8 |
| 27 | Cobalto | 9 |
| 28 | Níquel | 10 |
| 29 | Cobre | 11 |
| 30 | Zinc | 12 |
| 31 | Galio | 3 |
| 32 | Germanio | 4 |
| 33 | Astato | 5 |
| 34 | Selenio | 6 |
| 35 | Bromo | 7 |
| 36 | Kriptón | 8 |
| 37 | Rubidio | 1 |
| 38 | Estroncio | 2 |
| 39 | Itrio | 3 |
| 40 | Circonio | 4 |
| 41 | Niobio | 5 |
| 42 | Molibdeno | 6 |
| 43 | Tecnecio | 7 |
| 44 | Rutenio | 8 |
| 45 | Rodio | 9 |
| 46 | Paladio | 10 |
| 47 | Plata | 11 |
| 48 | Cadmio | 12 |
| 49 | Indio | 3 |
| 50 | Estaño | 4 |
| 51 | Antimonio | 5 |
| 52 | Telurio | 6 |
| 53 | Yodo | 7 |
| 54 | Xenón | 8 |
| 55 | Cesio | 1 |
| 56 | Bario | 2 |
| 57 | Lantano | 3 |
| 58 | Cerio | 4 |
| 59 | Praseodimio | 5 |
| 60 | Neodimio | 6 |
| 61 | Prometio | 7 |
| 62 | Samario | 8 |
| 63 | Europio | 9 |
| 64 | Gadolinio | 10 |
| 65 | Terbio | 11 |
| 66 | Disprosio | 12 |
| 67 | Holmio | 13 |
| 68 | Erbio | 14 |
| 69 | Tulio | 15 |
| 70 | Iterbio | 16 |
| 71 | Lutecio | 3 |
| 72 | Hafnio | 4 |
| 73 | Tántalo | 5 |
| 74 | Wolframio Tungsteno |
6 |
| 75 | Renio | 7 |
| 76 | Osmio | 8 |
| 77 | Iridio | 9 |
| 78 | Platino | 10 |
| 79 | Oro | 11 |
| 80 | Mercurio | 12 |
| 81 | Talio | 3 |
| 82 | Plomo | 4 |
| 83 | Bismuto | 5 |
| 84 | Polonio | 6 |
| 85 | Astato | 7 |
| 86 | Radón | 8 |
| 87 | Francio | 1 |
| 88 | Radio | 2 |
| 89 | Actinio | 3 |
| 90 | Torio | 4 |
| 91 | Protactinio | 5 |
| 92 | Uranio | 6 |
| 93 | Neptunio | 7 |
| 94 | Plutonio | 8 |
| 95 | Americio | 9 |
| 96 | Curio | 10 |
| 97 | Berkelio | 11 |
| 98 | Californio | 12 |
| 99 | Einstenio | 13 |
| 100 | Fermio | 14 |
| 101 | Mendelevio | 15 |
| 102 | Nobelio | 16 |
| 103 | Laurencio | 3 |
| 104 | Rutherfordio | 4 |
| 105 | Dubnio | 5 |
| 106 | Seaborgio | 6 |
| 107 | Bohrio | 7 |
| 108 | Hasio | 8 |
| 109 | Meitnerio | 9 |
| 110 | Darmstatio | 10 |
| 111 | Roentgenio | 11 |
| 112 | Copernicio | 12 |
| 113 | Nihonio | 3 |
| 114 | Flerovio | 4 |
| 115 | Moscovio | 5 |
| 116 | Livermorio | 6 |
| 117 | Teneso | 7 |
| 118 | Oganesón | 8 |
Vea también Tabla periódica y Átomo.
Cómo citar: Rhoton, Stephen (09/07/2025). "Electrones de valencia". En: Significados.com. Disponible en: https://www.significados.com/electrones-de-valencia/ Consultado: