Qué es una Molécula
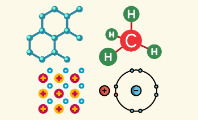
Una molécula es la parte más pequeña de una sustancia que determina las propiedades físicas y químicas de la misma. Está compuesta por dos o más átomos unidos entre sí, y se sitúa en el segundo nivel de organización de la materia.
Una de las moléculas más simples es la del hidrógeno gaseoso, donde dos átomos de hidrógeno se juntan mientras comparten sus electrones. Hay moléculas mucho más complejas, con cientos y hasta miles de átomos unidos, como es el caso de las proteínas, el almidón y otros polímeros.
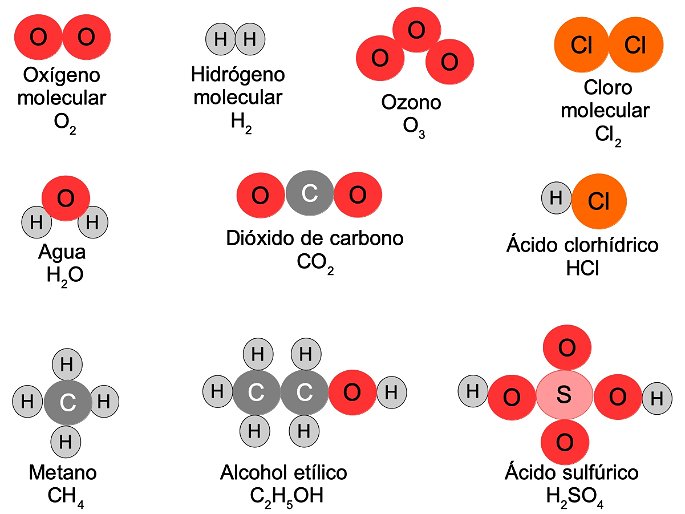
Existen moléculas homonucleares, es decir, que están formadas por un único tipo de átomo, como el gas hidrógeno H2, el oxígeno molecular con dos átomos de oxígeno O2 y el ozono con tres átomos de oxígeno O3.
Otras moléculas combinan diferentes átomos, como el agua, donde dos átomos de hidrógeno se ligan a un átomo de oxígeno, y el dióxido de carbono, donde un carbono se une a dos oxígenos.
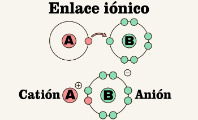
Las moléculas se forman mediante enlaces químicos, que suelen ser covalentes o iónicos. Cuando dos o más átomos comparten, ceden o aceptan electrones, se forma así una unión estable que otorga a la sustancia una serie de propiedades físicas y químicas únicas.
Por ejemplo, el oxígeno molecular son dos átomos de oxígeno que comparten un par de electrones entre ellos. De esta forma, alcanzan una configuración electrónica estable similar a la de los gases nobles.
Por tanto, la molécula se diferencia del átomo en que este pertenece al primer nivel de organización de la materia. Asimismo, una molécula siempre se compone de varios átomos, mientras que un átomo se compone de electrones, protones, neutrones y otras partículas subatómicas.
Características de las moléculas
Masa molecular: la masa de una molécula es la suma de las masas de los átomos que la forman. Por ejemplo, la masa molecular del agua es 18 unidades de masa atómica (uma), que es igual a la masa de dos hidrógenos (1 uma) y un oxígeno (16 uma).
Estructura molecular: las moléculas pueden tener una forma lineal, como el dióxido de carbono; una forma triangular, como la molécula de agua; formar anillos, como el benceno; o presentar ramificaciones, como es el caso de muchas biomoléculas.
Tamaño molecular: las moléculas pueden ser diatómicas, con dos átomos en su composición, como el monóxido de carbono CO y el ácido clorhídrico HCl; triatómicas, como el dióxido de carbono (CO2) y el agua (H2O); o poliatómicas, con más de tres átomos, como la glucosa (C6H12O6).
Polaridad: las moléculas pueden ser polares o no polares. La polaridad de las moléculas viene dada por su estructura y la diferencia que tengan sus átomos en atraer los electrones de los otros átomos. Así, el agua es una molécula polar, porque el oxígeno atrae los electrones de los hidrógenos, concentrando electrones en una de las puntas del triángulo molecular.
Fuerzas intermoleculares: entre moléculas se establecen fuerzas de atracción que permiten su unión, principalmente mediante enlaces covalentes o iónicos.
Vea también Enlace covalente y Enlace iónico.
Tipos de moléculas
Según el número de elementos que forman la molécula:
- Moléculas homonucleares: están formadas por átomos de un solo elemento, como sucede con el hidrógeno (H2), el oxígeno molecular (O2), el ozono (O3), el cloro molecular (Cl2) o el azufre molecular (S8).
- Moléculas heteronucleares: son las moléculas compuestas por átomos que pertenecen a dos elementos o más, como el sulfato de hierro II (FeSO4), el tetracloruro de carbono (CCl4) y el agua oxigenada o peróxido de hidrógeno (H2O2).
Según la presencia de enlaces de carbono-hidrógeno:
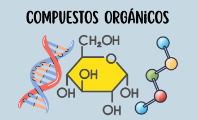
- Moléculas orgánicas: denominadas también biomoléculas, son aquellas que se componen principalmente de átomos de carbono e hidrógeno. También suelen contener otros elementos, como oxígeno, nitrógeno, azufre y fósforo. Algunos ejemplos son las proteínas, los ácidos nucleicos y los azúcares.
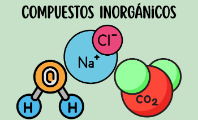
- Moléculas inorgánicas: son moléculas que no suelen poseer átomos de carbonos, y si los tienen, no se enlazan con átomos de hidrógeno. Algunos ejemplos son la sal (NaCl), el dióxido de carbono (CO2), los carbonatos y los cianuros.
Según la polaridad de la molécula:
- Moléculas polares: son aquellas en que los electrones se concentran más en una región de la molécula, lo que genera una carga ligeramente negativa en dicha región y una carga ligeramente positiva en el resto de la molécula. Algunos ejemplos son el agua (H2O) y el etanol (C2H6O).
- Moléculas apolares: son aquellas en que los electrones se distribuyen de una forma más equitativa a lo largo de la molécula. Debido a ello, no presenta una carga significativa en ninguna región de la molécula, sea positiva o negativa. Dos ejemplos son el dióxido de carbono (CO2) y el metano (CH4).
Según el número de átomos que conforma la molécula:
- Moléculas discretas: se componen de un número definido de átomos, cuya proporción nunca cambia. Por ejemplo, el monóxido de carbono (CO), el nitrato de plata (AgNO3), el amoniaco (NH3) o la sacarosa (C12H22O11).
- Macromoléculas: también llamadas polímeros, se componen por un gran número de átomos, del orden de los centenares o miles, y pueden constituirse de grupos de átomos que se repiten varias veces. Ejemplos a destacar son el ADN, el polietileno y las proteínas.
Vea también:
Referencias
Atkins, P. Jones, L., Laverman, L. (2016) Chemical principles-The Quest for Insights.
Salvat, J. (director) (1987) Enciclopedia Salvat de Ciencia y Técnica. Salvat Editores. Barcelona.
Zumdahl, S.S., Zumdahl, S.A. (2014) Chemistry 9th ed. Cengage Learning. CA.
Cómo citar: Fernandes, Ana (13/06/2025). "Qué es una Molécula". En: Significados.com. Disponible en: https://www.significados.com/molecula/ Consultado: