Enlace covalente
Un enlace covalente es una fuerza que une a dos átomos de elementos no metálicos para formar una molécula. Lo fundamental en esa unión es el hecho de que los átomos comparten pares de electrones de su capa más superficial (llamada capa de valencia) para lograr la estabilidad de la molécula que se ha formado con el enlace.
A la tendencia de los elementos de alcanzar una configuración estable se le conoce como regla del octeto, y es fundamental para la formación de enlaces covalentes y otros tipos de enlaces químicos (como los iónicos).
Dependiendo de la capacidad de los átomos para atraer electrones, los enlaces covalentes pueden ser polares o no polares. También pueden ser simples, dobles o triples, según la cantidad de electrones que comparten.
Características de los enlaces covalentes
- Los enlaces covalentes son más estables cuando son no polares, es decir, cuando la electronegatividad de los átomos es similar.
- Solo se forman entre elementos no metálicos (oxígeno (O), hidrógeno (H), nitrógeno (N), etc.
- Los electrones se comparten siempre en pares, bien sea en enlaces simples, dobles (cuatro electrones) o triples (seis electrones).
Tipos de enlaces covalentes
Los enlaces covalentes se clasifican en función de la electronegatividad de los átomos del enlace y del número de electrones compartidos entre ellos.
Enlace covalente polar
Una molécula está compuesta por más de un átomo. Cuando hay un átomo que atrae a los electrones con mayor intensidad, se genera una mayor concentración de electrones en esa parte de la molécula. Este fenómeno se llama polaridad.
La parte de la molécula donde se concentran los electrones tiene una carga parcial negativa, mientras la otra región de la molécula tiene una carga parcial positiva.
Por eso, este tipo de enlace recibe el nombre de “polar”, porque hay una polarización o distribución poco equitativa de los electrones que conforman la molécula.
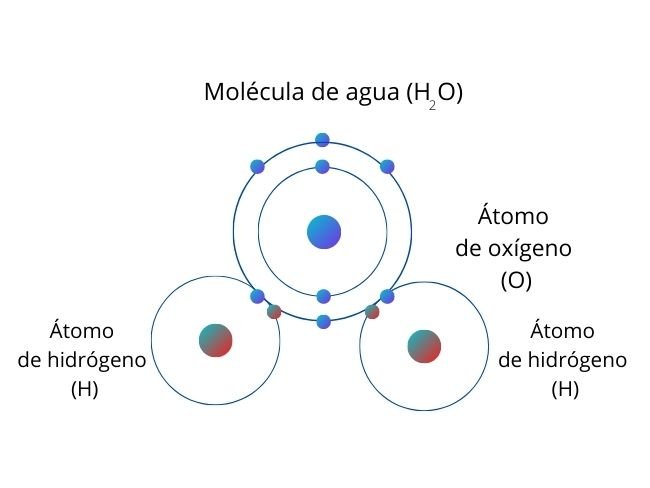
En una molécula de agua (H2O), el átomo de oxígeno es el que tiene mayor polaridad, por lo que atrae a los electrones del hidrógeno.
Enlace covalente no polar
Ocurre cuando los pares de electrones se comparten entre átomos que tienen una electronegatividad igual o muy similar. Esto favorece una distribución equitativa de los electrones.
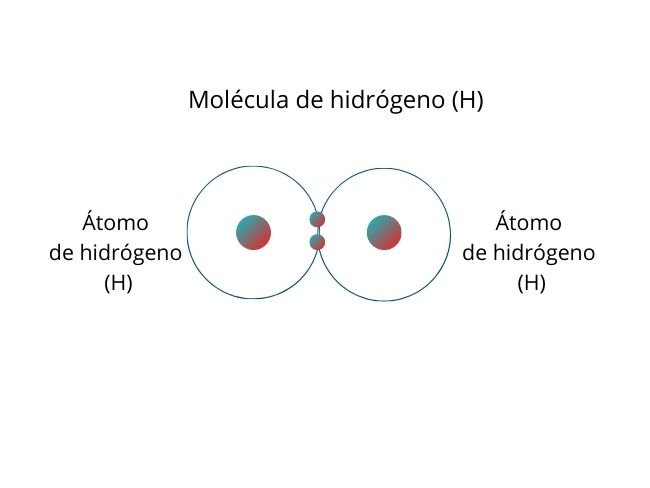
La molécula de hidrógeno (H), compuesta por dos átomos de hidrógeno, es un ejemplo de enlace covalente no polar.
Enlace covalente dativo o coordinado
Este tipo de enlace recibe este nombre ya que solo uno de los átomos en el enlace aporta sus electrones. Este átomo se llama dativo, y el átomo que recibe los electrones se denomina átomo receptor. Gráficamente, se identifica con una flecha.
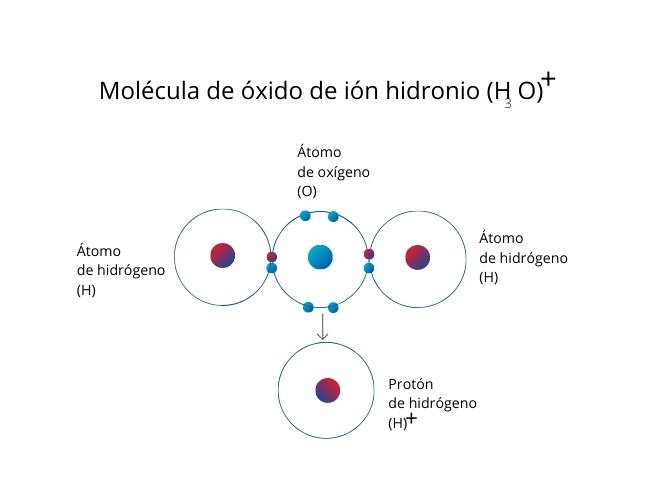
En la molécula de hidrogenión o ion hidronio (H3O)⁺, el oxígeno aporta un par de electrones al ion de hidrógeno (protón).
Enlace covalente simple
Ocurre cuando cada átomo comparte un electrón para completar el par de electrones del enlace.
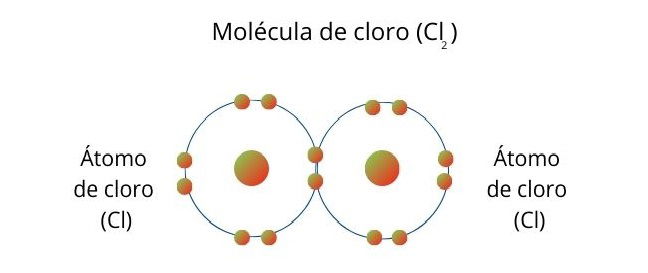
Una molécula de cloro (Cl2) se forma cuando los átomos comparten un electrón para completar 8 electrones en su capa de valencia cada uno.
Enlace covalente doble
Los enlaces dobles se generan cuando se comparten dos pares de electrones entre dos átomos, para un total de cuatro electrones compartidos.
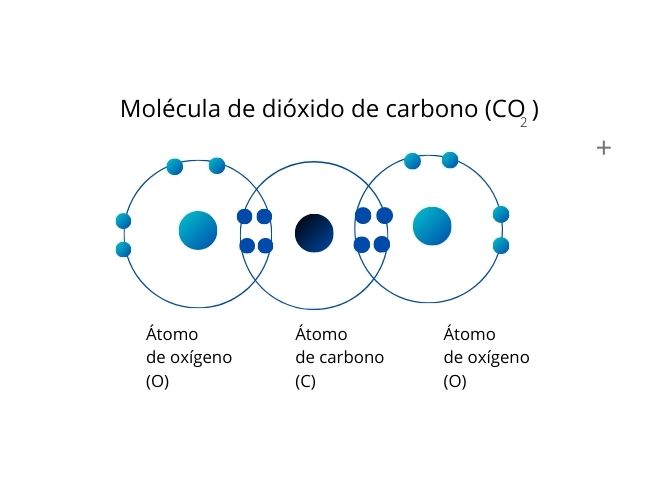
Un ejemplo es el dióxido de carbono (CO2), cuyos átomos de oxígeno comparten un par de electrones cada uno con el átomo de carbono.
Enlace covalente triple
Cuando los átomos comparten seis electrones (tres pares) se genera un enlace triple.
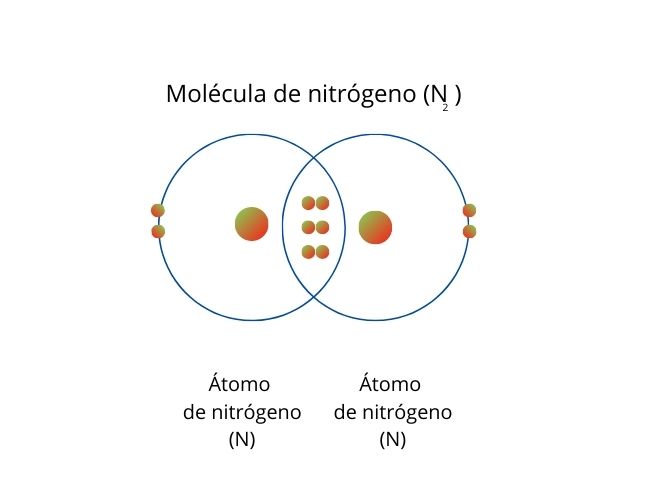
Un ejemplo es la molécula de nitrógeno (N2), cuyos átomos comparten tres pares de electrones.
La regla del octeto en los enlaces covalentes
Se conoce como regla del octeto a la tendencia que se observa en algunos elementos de la tabla periódica de alcanzar una configuración estable.
De hecho, los átomos más estables de la tabla periódica son los gases nobles como el argón (Ar) o el neón (Ne), que tienen 8 electrones en su capa de valencia.
Otros átomos tratan de alcanzar la estabilidad de los gases nobles reaccionando con otros átomos con quienes puedan compartir electrones hasta llegar a 8.
Un ejemplo es la molécula de cloro (Cl), que está compuesta por dos átomos. Cada uno de ellos tiene 7 electrones, por lo que cada átomo comparte un electrón para que el otro pueda llegar a 8 electrones.
La regla del octeto tiene excepciones, ya que no se cumple con las moléculas de berilio (Be) y boro (B).
La importancia de la regla del octeto es que al conocer la tendencia que tienen los átomos para estructurarse, se puede predecir cómo se van a comportar al combinarse con otros elementos.
Esta regla fue descubierta por por el fisicoquímico Gilbert Newton Lewis en 1916.
Quizá te interese leer:
Cómo citar: Editorial, Equipo (15/12/2020). "Enlace covalente". En: Significados.com. Disponible en: https://www.significados.com/enlace-covalente/ Consultado: