Ionización
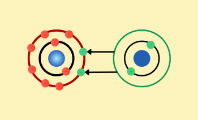
La ionización es un proceso, tanto químico como físico, a través del cual un átomo o una molécula neutra se transforma en una cargada eléctricamente, llamada ion. Los iones son átomos o moléculas que contienen carga eléctrica debido a la falta o exceso de electrones respecto a un átomo o molécula neutra.
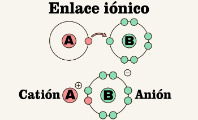
Esto sucede cuando el número de electrones del átomo o molécula cambia. Si pierde electrones, se convierte en un catión (con carga positiva). Si gana electrones, se transforma en un anión (con carga negativa).
Este fenómeno ocurre porque los electrones, que orbitan el núcleo del átomo, pueden ser transferidos a otras sustancias o arrancados mediante la acción de la energía.
La ionización es fundamental en numerosos procesos naturales y tecnológicos. Desde reacciones químicas en soluciones hasta la generación de plasma, el funcionamiento de detectores de radiación, la formación de rayos en la atmósfera y el equilibrio ácido-base en el cuerpo humano.
Además, la ionización está estrechamente relacionada con conceptos como la energía de ionización, la electronegatividad y la disociación química, todos fundamentales para comprender cómo se comportan las sustancias a nivel atómico y molecular.
Los iones, tanto positivos como negativos, se encuentran presentes tanto en la naturaleza como en los materiales sintéticos, equipos eléctricos, ropa, entre otros.
Tipos de ionización
Ionización química
Se da cuando un átomo o molécula reacciona químicamente con otra sustancia, provocando una transferencia de electrones. Este tipo de ionización ocurre, por ejemplo, cuando el sodio (Na) reacciona con el cloro (Cl): el sodio pierde un electrón (formando Na⁺) y el cloro lo gana (formando Cl⁻), creando así cloruro de sodio (NaCl).
Puede producirse por:
- Diferencias en la electronegatividad de los elementos que reaccionan.
- Formación o disolución de compuestos iónicos.
Ionización física
En este caso, el átomo o molécula pierde electrones debido a una fuente de energía externa. Esto ocurre, por ejemplo, cuando se expone a:
- Rayos X
- Rayos gamma
- Luz ultravioleta de alta energía
- Descargas eléctricas o altas temperaturas
Esta energía arranca uno o más electrones del átomo, convirtiéndolo en un ion. Es un proceso común en el plasma (el cuarto estado de la materia), en las capas altas de la atmósfera y en tecnologías como los ionizadores de aire.
Vea también: Qué es un ion
Energía de ionización
La energía de ionización o potencial de ionización es la cantidad mínima de energía que se debe suministrar a un átomo neutro, gaseoso y en estado fundamental para remover su electrón más débilmente retenido y convertirlo en un catión monopositivo también en estado gaseoso.
Esta energía es un indicador de qué tan fácilmente un átomo puede ser ionizado: cuanto mayor sea, más difícil será quitarle un electrón.
Unidades de medida:
- Electrón-voltios por átomo (eV/átomo)
- Kilocalorías por mol (kcal/mol)
- Kilojulios por mol (kJ/mol)
La ionización puede producirse en etapas sucesivas, dependiendo de cuántos electrones se extraigan. Primero se eliminan los electrones de valencia (más externos), y luego los más cercanos al núcleo, lo que requiere una energía cada vez mayor.
Constante de ionización
La constante de ionización, también llamada constante de disociación ácida (Ka), es un valor que indica la capacidad de un ácido para liberar protones (H⁺) en solución acuosa. Se trata de una medida del grado de ionización de una sustancia.
Mientras más alto sea el valor de Ka, más fuerte será el ácido, ya que se disocia con mayor facilidad en iones. Este concepto también se aplica a bases débiles, utilizando la constante Kb.
Ionización del agua
El agua pura es un electrolito débil, lo que significa que se ioniza en muy pequeña proporción. En condiciones normales, una pequeña fracción de las moléculas de agua se disocia en iones hidronio (H₃O⁺) e hidroxilo (OH⁻):
H₂O + H₂O ⇌ H₃O⁺ + OH⁻
Este equilibrio químico es conocido como el producto iónico del agua (Kw). Su valor a 25 °C es:
Kw = [H₃O⁺] × [OH⁻] = 1 × 10⁻¹⁴
Este valor es la base para la definición de la escala de pH, que permite medir la acidez o alcalinidad de una solución. Cuanto mayor es la concentración de H₃O⁺, más ácida es la solución; si predomina el OH⁻, se considera básica o alcalina.
Vea también pH.
Cómo citar: Significados, Equipo (05/06/2025). "Ionización". En: Significados.com. Disponible en: https://www.significados.com/ionizacion/ Consultado: