Qué es el pH
El pH es una medida de acidez o alcalinidad que indica la cantidad de iones de hidrógeno o hidronio que hay en una solución o sustancia. En esta medida, mientras menor es el valor, más ácida es la sustancia; mientras más alto es el valor, más alcalina o básica es.
Las siglas pH significan potencial hidrógeno o potencial de iones de hidrógeno. El término fue designado en 1909 por el bioquímico danés Søren Sørensen, al definirlo como el logaritmo negativo en base 10 de la actividad de los iones de hidrógeno (H+) o hidronio (H3O+). Se diferencia del pOH en que este indica el potencial de iones hidroxilos (OH-).

Para indicar el pH, usualmente se toma una escala desde 0 como el valor más ácido hasta 14, que sería el más básico. Por ejemplo, la lluvia natural es ligeramente ácida, próxima a un valor neutro de pH (de 7). No obstante, cuando se combina con sustancias como los óxidos de nitrógeno o dióxidos de azufre, se produce la llamada lluvia ácida, cuyo pH es menor.
El pH es de gran importancia para el ser humano y los seres vivos. Por ejemplo, es vital tener un pH apropiado en la sangre y en el interior de las células, pues las subidas o bajadas de pH afectan al funcionamiento de las células.
Otro ejemplo de su importancia es que el pH afecta a factores como la disponibilidad y solubilidad de nutrientes en el suelo. Si el pH no es el adecuado, las plantas tendrán dificultad de absorber y asimilar los minerales que necesita. En general, un suelo fértil y adecuado para el cultivo posee un pH entre 5,5 y 7.
Escalas de pH
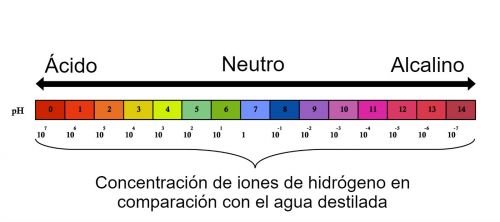
La escala numérica que mide el pH de las sustancias comprende de 0 a 14. Las sustancias más ácidas se acercan al número 0, y las más alcalinas (o básicas) son las que se aproximan al número 14. Sin embargo, existen sustancias neutras como el agua o la sangre, cuyo pH está entre de 7 y 7,3.
A grandes rasgos:
- Si el pH es menor que 7, entonces la sustancia es ácida.
- Si pH es igual o próximo a 7, la sustancia es neutra.
- Si pH es mayor que 7, la sustancia es básica o alcalina.
Por tanto, esta escala de valor numérico indica el pH de las soluciones ácidas y alcalinas. Cuando es ácida, es decir, con pH menor que 7, hay una mayor concentración de iones de hidrógeno. Si es alcalina, el pH es mayor que 7 y se trata de una base, con menor concentraciones de iones hidrógeno.
Las sustancias ácidas como el jugo de limón tienen un pH entre 2 y 3; otras, como la orina, entre 4 y 7. Como ejemplos de sustancias muy ácidas están los jugos gástricos, que tienen un valor entre 1 y 2, y los ácidos de baterías, que se encuentran entre 1 y 0.
Por el contrario, las sustancias alcalinas o base tiene valores más altos, como la leche de magnesia, con un pH entre 9 y 10, y los limpiadores con amoniaco, cuyo valor está entre 10 y 11.
Tabla de ejemplos de pH
A continuación mostramos una tabla de pH con varios ejemplos de sustancias organizadas según su pH aproximado:
| pH | Ejemplos de sustancias |
|---|---|
| 0 | Ácido en las baterías |
| 1 | Jugo gástrico, ácido sulfúrico, ácido clorhídrico |
| 2 | Jugo de limón, vinagre |
| 3 | Jugo de naranja, bebidas carbonatadas |
| 4 | Lluvia ácida, cerveza, café, jugo de tomate |
| 5 | Lluvia de agua pura, bananos, piel humana |
| 6 | Lago limpio, leche |
| 7 | Agua pura, sangre |
| 8 | Agua de mar, huevos |
| 9 | Bicarbonato de sodio, leche de magnesia |
| 10 | Detergente |
| 11 | Solución de amoniaco |
| 12 | Agua jabonosa, cal |
| 13 | Blanqueador, lejía casera |
| 14 | Hidróxido de sodio, limpiador líquido para desagües |
Aquí podemos ver cómo sustancias como el jugo de limón o de naranja son mucho más ácidas que la leche o el bicarbonato de sodio. Por su parte, los productos de limpieza acostumbran a ser muy básicos, como los detergentes o la lejía casera.
Ahora, el agua pura y la sangre son dos sustancias conocidas por ser muy próximas a un pH neutro, lo que implica que la concentración de protones (H+) e hidroxilos (OH-) es casi igual.
Fórmula del pH
El pH se calcula con la siguiente fórmula:
pH = -log10[H+]
En el que H+ es la concentración de iones de hidrógeno en la sustancia en M (molaridad). La molaridad es la cantidad de moles que hay de un elemento en un litro de sustancia.
Por ejemplo, a 25 °C, un litro de agua pura posee una concentración de iones de hidrógeno de 10-7 M, o sea, hay 10-7 moles de iones en 1 litro de agua. Si aplicamos la fórmula, hallaremos el pH:
pH = -log10[H+] = -log10[10-7] = 7
De esta forma, comprobamos que el agua pura tiene un pH neutro. Si analizamos una sustancia más ácida, tendrá mayor concentración de iones de hidrógeno, por lo que el pH será menor. Imaginemos que una sustancia tiene una concentración de H+ de 10-3,5 M.
Aplicamos la fórmula:
pH = -log10[H+] = -log10[10-3,5] = 3,5
Como el pH, de 3,5, es más cercano a 0, estamos ante una sustancia más ácida.
Cómo medir el pH
Existen diferentes métodos y herramientas que nos permiten medir el pH de una sustancia, sea de forma aproximada o exacta. Una manera fácil es utilizando una tira de papel tornasol. Cuando el papel entra en contacto con la sustancia, cambia de color acorde a la acidez o alcalinidad de dicha sustancia.
También se pueden calcular las medidas del pH utilizando un potenciómetro o pH-metro. Se trata de un sensor que determina el pH de una sustancia a través de una membrana de vidrio que separa dos soluciones de diferente concentración de protones.
Otro método preciso para medir el pH es la titulación o valoración ácido-base, una técnica analítica en el que se neutraliza un ácido o base. Este método se divide en acidimetría, que es una titulación con solución ácida estandarizada, y alcalimetría, con solución básica estandarizada.
Por último, en ocasiones se emplean los indicadores ácido-base, sustancias que cambian de color dependiendo del pH de la solución a analizar. Algunos indicadores comunes son el azul de bromotimol o la fenolftaleína.
Para determinar empíricamente el pH de un ambiente, utilizamos los llamados indicadores ácido-base. En la práctica, son sustancias que cambian de color cuando se ven afectadas por diferentes condiciones de pH. Hay tres tipos de tales indicadores:
El pOH
El pOH es el logaritmo negativo en base a 10 de la actividad de los aniones hidroxilo. Tiene las mismas propiedades del pH en disolución acuosa de valor entre 0 y 14, pero en este caso las soluciones con pOH mayores a 7 son ácidas, y básicas o alcalinas las que tengan valores menores de 7.
Se calcula con la ecuación pOH = - log10[OH-]. Asimismo, en la mayoría de casos se puede establecer la siguiente relación con el pH: pOH + pH = 14.
Vea también:
Cómo citar: Rhoton, Stephen (11/06/2025). "Qué es el pH". En: Significados.com. Disponible en: https://www.significados.com/ph/ Consultado: