Qué es la termodinámica
La termodinámica es la rama de la física que estudia la relación entre el calor, el trabajo y la transferencia de energía entre varios cuerpos o sistemas. Asimismo, también verifica las condiciones en que uno o varios sistemas pueden alcanzar el equilibrio térmico.
Comprender los procesos termodinámicos es importante en áreas como la ingeniería industrial o química. Por ejemplo, cuando se emplean varias máquinas que precisan de grandes cantidades de energía para funcionar, la termodinámica es esencial para optimizarlas.
En la termodinámica hay diversas magnitudes que se suelen tener en cuenta en el estudio de los sistemas termodinámicos. Algunas magnitudes comunes son la temperatura, la cantidad de calor, el trabajo producido, la energía interna, la entropía y el volumen.
La termodinámica está regida por los cuatro principios de la termodinámica, enumerados como la primera, segunda y tercera ley, además de la ley cero. En conjunto, estos principios explican cómo un sistema alcanza el equilibrio térmico, de qué forma fluye la energía y qué características presenta la materia en el cero absoluto, entre otras cosas.
El físico y jurista alemán Otto von Guericke fue quien dio inicio al estudio de la termodinámica, en 1650. Tras diseñar la primera bomba de vacío y demostrar las propiedades del vacío, otros científicos tomaron el relevo en el estudio de la termodinámica. Algunas figuras claves para sentar las bases fueron Robert Boyle, Denis Papin, Thomas Savery, Joseph Black y Sadi Carnot.
Tipos de sistemas en termodinámica
Para comprender la termodinámica y sus leyes, es importante saber los tipos de sistemas termodinámicos que existen y su comportamiento. Todo a nuestro alrededor está compuesto por sistemas y la mayoría de los que conocemos intercambian energía con otros.
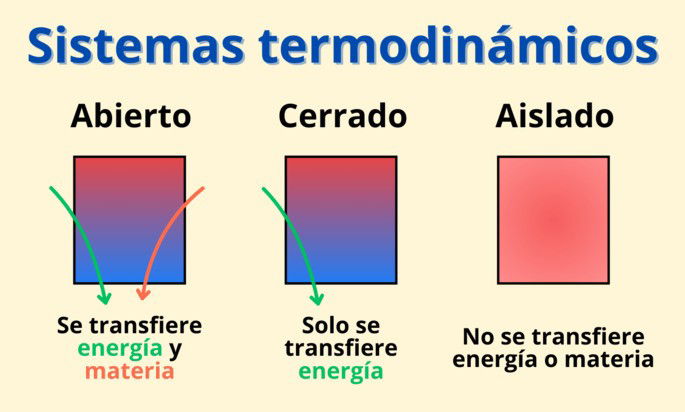
Los sistemas están clasificados en tres tipos:
Sistemas abiertos: son sistemas en los que existe un intercambio de energía y materia con el exterior. A raíz de este intercambio, la cantidad de energía y materia que hay en el sistema varía con el paso del tiempo. Un ejemplo es la hoguera, pues la llama transfiere calor al entorno y las cenizas se esparcen en el aire.
Sistemas cerrados: son aquellos en que solo existe un intercambio de energía con el exterior. Por tanto, la cantidad de energía cambia a lo largo del tiempo, pero la materia se mantiene invariable. Un ejemplo es al calentar agua en una olla cerrada; las partículas del agua quedan dentro del sistema, pero se transfiere calor entre el agua y la olla.
Sistemas aislados: son unos sistemas teóricos en los que no existe un intercambio de energía o materia. En la práctica, siempre hay un grado de transferencia de energía.
Asimismo, existen dos tipos de sistema según el estado en que se encuentra:
- Sistemas activos: si hay un intercambio de energía, se dice que el sistema está activo, incluso sin haber un intercambio de materia.
- Sistemas en reposo o equilibrio: si no existe intercambio de energía o materia, se considera que el sistema está en reposo o en equilibrio.
Leyes de la termodinámica
Existen cuatro leyes en la termodinámica que explican cómo funciona y se trasmiten el calor y la energía. A continuación, hacemos un resumen de cada una de ellas.
Ley cero
La ley cero o del equilibrio térmico simplemente nos indica que si los sistemas A y B están en equilibrio térmico, y los sistemas B y C también lo están, A y C han de estar en equilibrio.
Para aclarar, dos sistemas se hallan en equilibrio térmico cuando ambos se encuentran a la misma temperatura. A raíz de ello, uno puede determinar que entre ellos no existe un intercambio de energía en forma de calor.
Primera ley
La primera ley o primer principio de la termodinámica establece que la energía no se crea ni se destruye, sino que se transforma o se transfiere. Es decir, siempre está en movimiento en el sistema o entre varios sistemas.
Esta ley suele enunciarse junto con la fórmula ΔU = Q - W. Esta ecuación simplemente indica que la variación de energía interna (ΔU) es en función del calor transferido (Q) y el trabajo producido (W).
Un ejemplo de la energía transformándose en otras energías es:
- La energía solar es transformada en energía eléctrica para una estación de servicio.
- Esa energía eléctrica puede ser utilizada para cargar la batería del carro eléctrico.
- El carro eléctrico es capaz de convertir la energía eléctrica acumulada en mecánica, en forma de desplazamiento.
Segunda ley
La segunda ley o principio de la termodinámica enuncia que la entropía o grado de desorden en el universo siempre tiende a aumentar. Esta es una forma de decir que un proceso natural o espontáneo es irreversible, es decir, evoluciona solamente en una dirección.
A raíz de lo anterior, los procesos solo se pueden revertir realizando un trabajo o transfiriendo energía. Por ejemplo, la sal de mesa se mezcla con el agua espontáneamente mediante un proceso que se llama dilución. Este proceso libera calor.
Para poder revertir ese proceso y volver a formar cristales de sal, debe aplicarse calor, el cual que permite evaporar el agua y separarla de la sal. El sistema absorbe calor.
Una fórmula que representa esta ley es ΔS ≥ ΔQ / T, en que ΔS es la variación de entropía, ΔQ es la variación de calor y T la unidad de temperatura.
Tercera ley
La tercera y última ley de la termodinámica nos explica qué sucede cuando la materia alcanza el cero absoluto. Llegado a este punto, la entropía del sistema es constante y mínima, ya que en el cero absoluto las partículas dejan de moverse y, por tanto, no transmiten energía.
Es una ley que solo se aplica a sistemas aislados y cuando la temperatura es de 0 Kelvin (cero absoluto). Aun así, es útil tener presente esta ley, pues es una forma de explicar por qué las partículas tienen menos energía cinética mientras más baja es la temperatura.
Vea también Leyes de la termodinámica y Física.
Calor y transferencia de calor en termodinámica
Según la física, el calor es el flujo de energía que existe cuando dos sistemas de temperaturas diferentes entran en contacto. El equilibrio térmico se alcanza cuando todos los sistemas involucrados alcanzan la misma temperatura.
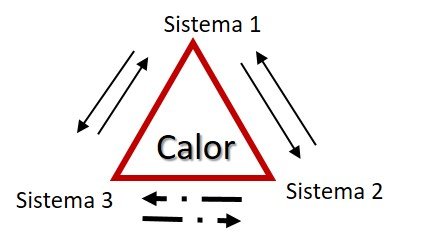
En los sistemas termodinámicos, si dos de ellos están en equilibrio con un tercer sistema, entonces también están en equilibrio entre sí. Por lo tanto, al alcanzar el equilibrio la temperatura es una constante.
Vea también:
Cómo citar: Rhoton, Stephen (14/08/2025). "Qué es la termodinámica". En: Significados.com. Disponible en: https://www.significados.com/termodinamica/ Consultado: