Oxidación
La oxidación es un fenómeno que se refiere al proceso químico que implica la pérdida de electrones por parte de un átomo, ion o molécula. Cuando esto ocurre, decimos que la sustancia ha aumentado su estado de oxidación.
Es común que este fenómeno suceda cuando un átomo o molécula se une al oxígeno. Sin embargo, el agente oxidante puede ser otra sustancia diferente al oxígeno, como el cloro (Cl), el iodo (I), el permanganato (MnO4-), y algunos ácidos y óxidos.

La oxidación del hierro es uno de los ejemplos más comunes para ilustrar este proceso. En presencia de oxígeno y agua, el hierro se oxida con el paso del tiempo, es decir, cede electrones al reaccionar con el oxígeno, formando óxido de hierro.
La fórmula de la reacción de oxidación que forma el óxido de hierro(III) es el siguiente:
Para que se dé esta reacción, el hierro (Fe) cede electrones al oxígeno, oxidándose en el proceso y aumentando su estado de oxidación. Al mismo tiempo, el oxígeno gana electrones y se reduce, disminuyendo así su estado de oxidación.
El proceso de oxidación suele comenzar en presencia de oxígeno u otros agentes oxidantes, y en condiciones que facilitan la reacción, como temperaturas altas. En el proceso de oxidación, las propiedades químicas de las sustancias reactivas cambian ligeramente debido a la pérdida o ganancia de electrones.
Al reaccionar en procesos de oxidación, un átomo puede cambiar su número de oxidación. Lo explicamos a continuación.
Número de oxidación
El número, estado o índice de oxidación indica el grado de oxidación de un átomo que forma parte de un compuesto. Cuando un átomo se uno a otro, puede ceder electrones, aumentando su número de oxidación, o atraerlos, disminuyendo dicho número.
El número de oxidación también se define como la carga hipotética que tendría un átomo de un compuesto si fuera un ion. Se representa de la siguiente forma:
- C1+ si es un átomo que cede al menos un electrón, por lo que ha aumentado su estado de oxidación.
- C1- si es un átomo que atrae al menos un electrón, por lo que ha disminuido su estado de oxidación.
Retomemos el ejemplo del óxido de hierro(III). Al tratarse del hierro(III), significa que cuando reacciona con el oxígeno, cada átomo de hierro presta 3 electrones. Por tanto, este hierro unido al oxígeno posee un número de oxidación de +3, representado como Fe3+.
En su lugar, cada átomo de oxígeno atrae dos electrones, es decir, este oxígeno unido al hierro presenta un número de oxidación de -2. Esto lo representamos como O2-.
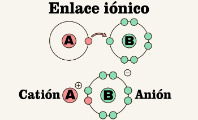
Cabe aclarar que el número de oxidación no es lo mismo que la carga eléctrica. Este concepto se utiliza también en los enlaces covalentes, que son un tipo de enlace en el que no se forman iones. En el caso de los enlaces iónicos, la carga de los átomos coincide con el número de oxidación.
De aquí concluimos que el número de oxidación puede tomar un número positivo o negativo, dependiendo de si el átomo pierde o gana electrones. En general se representan con números enteros, pero hay átomos en los que su estado de oxidación es un número fraccionario. Tal es el caso de Fe3O4: el estado de oxidación del hierro es +8/3.
Para determinar el número de oxidación, se tienen en cuenta las siguientes consideraciones:
- Un elemento en estado libre tiene un número de oxidación 0.
- La suma de los números de oxidación de un compuesto neutro ha de ser igual a 0.
- Si el compuesto es iónico, la suma total de los números de oxidación ha de ser igual a la carga eléctrica.
- En compuestos iónicos y covalentes, el elemento más electronegativo tendrá un estado de oxidación negativo, mientras que el menos electronegativo poseerá un estado de oxidación positivo.
- El número de oxidación del hidrógeno es +1 excepto en hidruros metálicos, en los que es -1, como en el NaH.
- El número de oxidación del oxígeno es -2 excepto en peróxidos (-1), en superóxidos (-1/2) o en el fluoruro de oxígeno (OF2), que es +2.
Vea también Óxido y Agente oxidante.
Ejemplos de oxidación
Algunos ejemplos de sustancias que han pasado por el proceso de oxidación para formarse son:
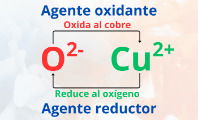
- La oxidación del cobre que genera óxido de cobre (CuO), en el que el cobre aumenta su estado de oxidación a +2 (Cu2+), y en el oxígeno se reduce a -2 (O2-).
- La formación del agua (H2O). El hidrógeno toma un número de oxidación de +1 (H1+), mientras que el oxígeno presenta un estado de oxidación de -2 (O2-). Por esa razón, han de enlazarse dos hidrógenos al oxígeno para tener un estado de oxidación global neutro.
- La reacción del magnesio con el azufre, formando MgS, en el que el magnesio aumenta su estado de oxidación a Mg2+, mientras que el número de oxidación del azufre disminuye a S2-.
- El ácido nítrico (HNO3), compuesto por un hidrógeno oxidado a H1+ que se une al nitrato, NO3-.
- La formación de la sal de mesa o NaCl, en que el sodio tiene un número de oxidación de +1 (Na1+), mientras que el cloro posee un índice de oxidación de -1 (Cl1-).
Tipos de oxidación
Las reacciones de oxidación se pueden clasificar de dos formas: oxidación lenta y oxidación rápida.
Oxidación lenta
La oxidación lenta es el proceso de oxidación que ocurre poco a poco, y genera muy poca energía en forma de calor. Estas oxidaciones están presentes en nuestro día a día, algunos a simple vista y otros formando invisiblemente parte de nuestra vida.
Por ejemplo, podemos registrar oxidación en la corrosión de metales como el hierro en contacto con el agua y oxígeno. También sucede en distintos procesos biológicos, como la respiración, la fotosíntesis de las plantas, la oxidación de la glucosa o de los ácidos grasos, y la fermentación de variadas sustancias, como lácteos o alcoholes.
Te puede interesar Respiración celular.
Oxidación rápida
Los procesos de oxidación rápida ocurren durante una reacción química conocida como combustión y suelen generar una enorme cantidad de calor. Como consecuencia se generan aumentos considerables de temperatura y llamas.
Los hidrocarburos son propicios para este tipo de combustiones. Al generar una llama en el combustible en presencia de oxígeno, estos reaccionan a una velocidad tan alta que se genera mucho calor. Gracias a ello, podemos mover mecanismos en los vehículos para desplazarnos, por ejemplo.
Oxidación y reducción
La oxidación es el proceso químico en el que una molécula, átomo o ion pierde electrones y reducción es el proceso opuesto. Es decir, la reacción química que supone la ganancia de electrones por parte una molécula, átomo o ion.
A la simultaneidad de estos procesos se la conoce con el nombre de redox, contracción de las palabras reducción y oxidación.
Básicamente, el redox se refiere a la transferencia de electrones entre dos elementos o compuestos, donde el agente oxidante gana electrones, mientras que el agente reductor los pierde. Esta transferencia produce una variación en los estados de oxidación de los elementos, siendo que en el primero se reduce y en el segundo aumenta.
Vea también:
Cómo citar: Rhoton, Stephen (14/04/2025). "Oxidación". En: Significados.com. Disponible en: https://www.significados.com/oxidacion/ Consultado: